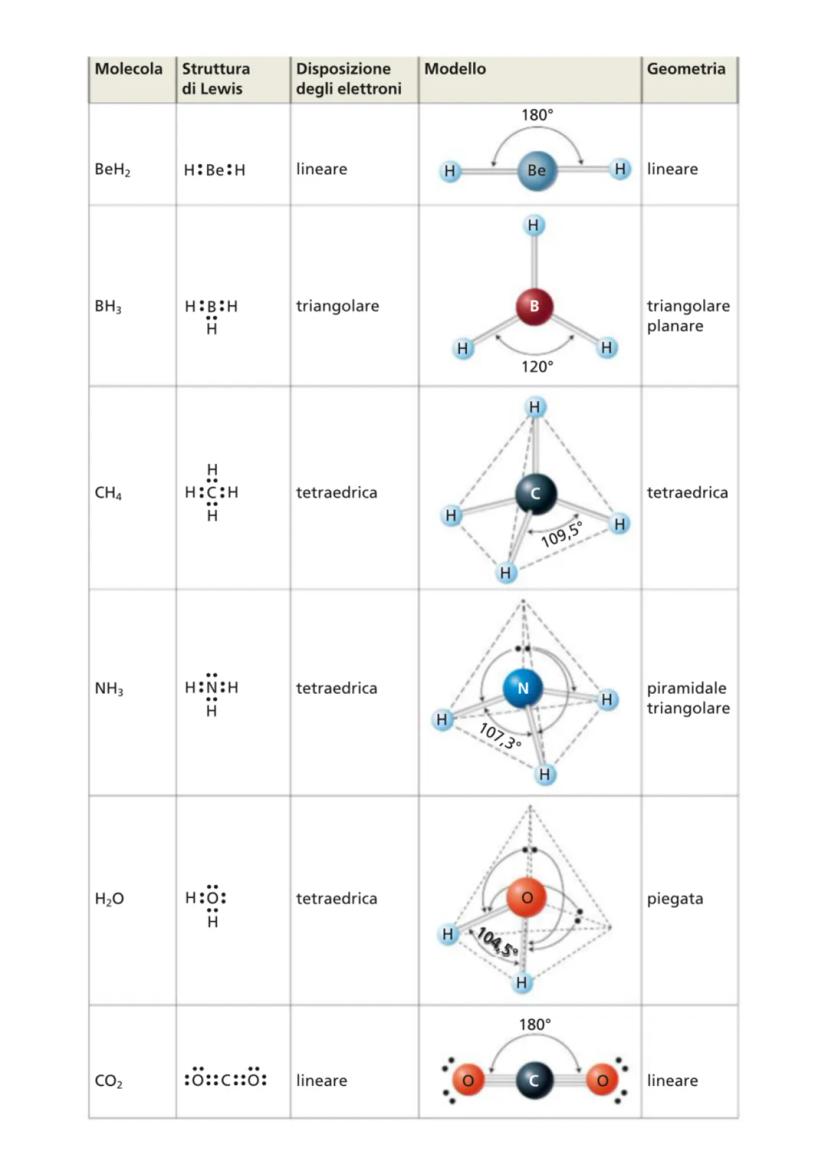
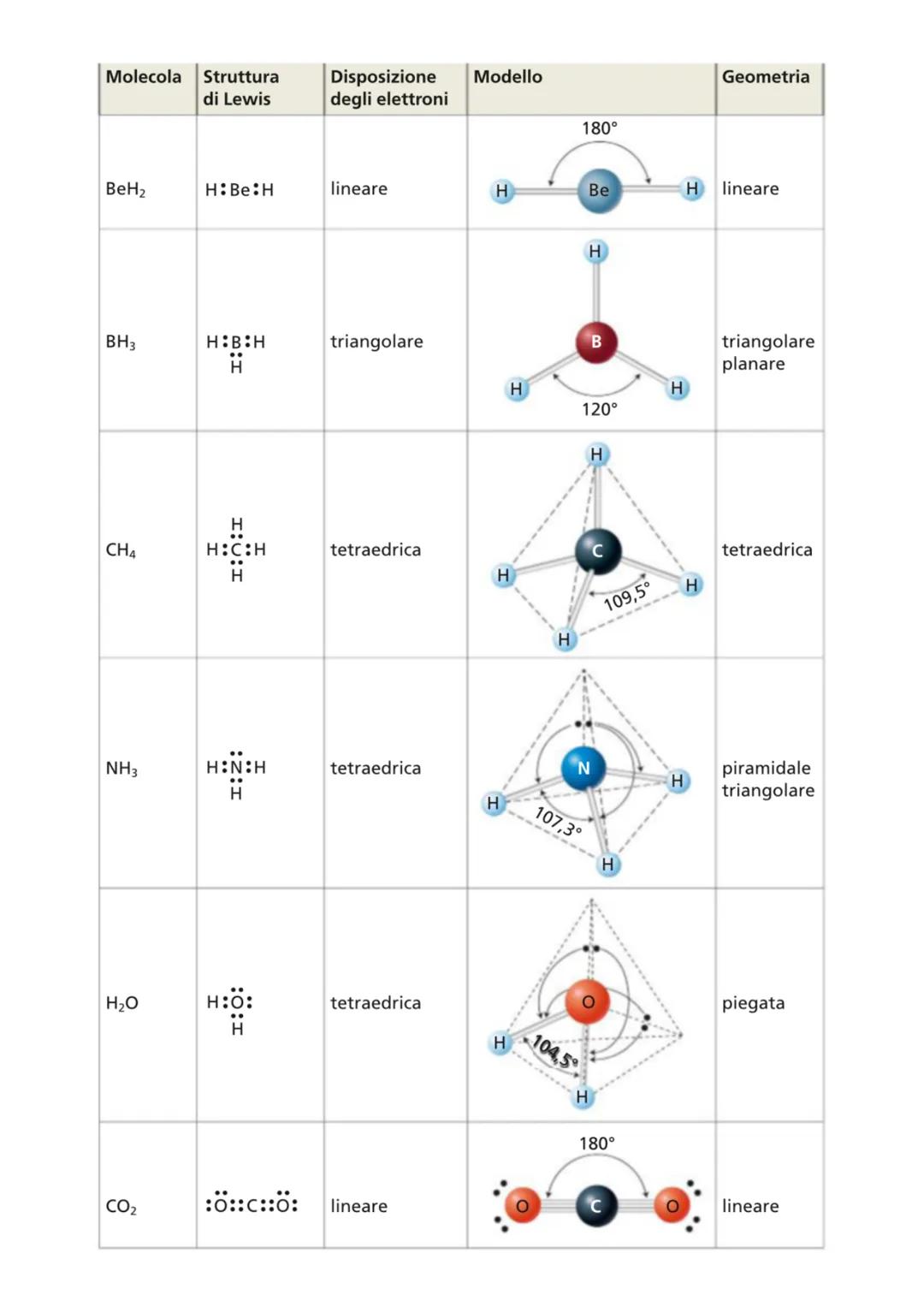
La chimica dell'acqua
L'acqua è una molecola con legami covalenti polari: l'ossigeno attira gli elettroni di legame, assumendo una carica parziale negativa, mentre gli idrogeni hanno una carica parziale positiva. Questa asimmetria rende l'acqua una molecola polare.
Il legame idrogeno è un'interazione fondamentale tra le molecole d'acqua e spiega molte delle sue proprietà uniche. Nel ghiaccio, i legami idrogeno formano un reticolo cristallino che occupa più spazio rispetto all'acqua liquida, rendendo il ghiaccio meno denso dell'acqua. Questa proprietà è fondamentale per la vita acquatica.
L'elevata tensione superficiale dell'acqua è dovuta all'attrazione tra le molecole: quelle in superficie sono attratte verso l'interno, creando una sorta di "pellicola". Questa proprietà, insieme alla capillarità (la capacità dell'acqua di risalire nei tubi sottili), è essenziale per il trasporto dell'acqua nelle piante.
💡 Senza i legami idrogeno, l'acqua non esisterebbe allo stato liquido alle normali condizioni ambientali: fonderebbe a -100°C e bollirebbe a -91°C!
L'acqua è un eccellente solvente per composti ionici e molecole polari. Può causare la dissociazione ionica di composti come il sale e la ionizzazione di sostanze con legami covalenti polari come HCl. Le soluzioni risultanti, contenenti ioni, sono dette "elettrolitiche" perché conducono elettricità.
L'acqua ha anche un elevato calore specifico 1cal/g°C e calori latenti di fusione 80cal/g e vaporizzazione 540cal/g. Queste proprietà permettono all'acqua di regolare la temperatura del nostro pianeta e dei nostri corpi, rendendo possibile la vita come la conosciamo.