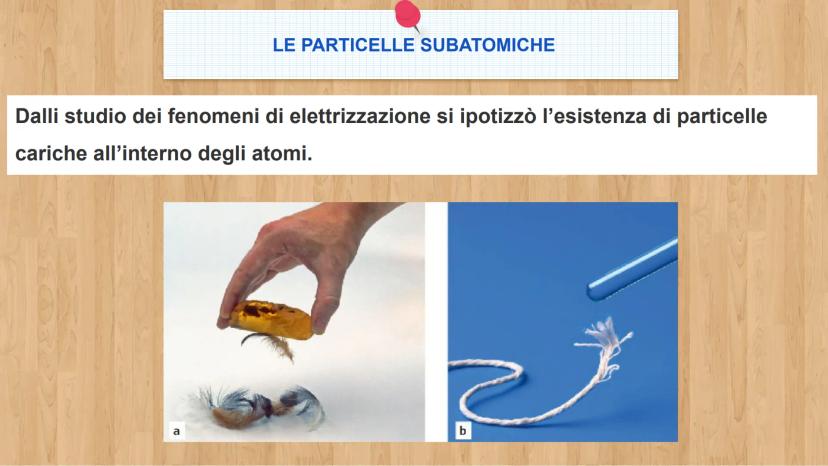
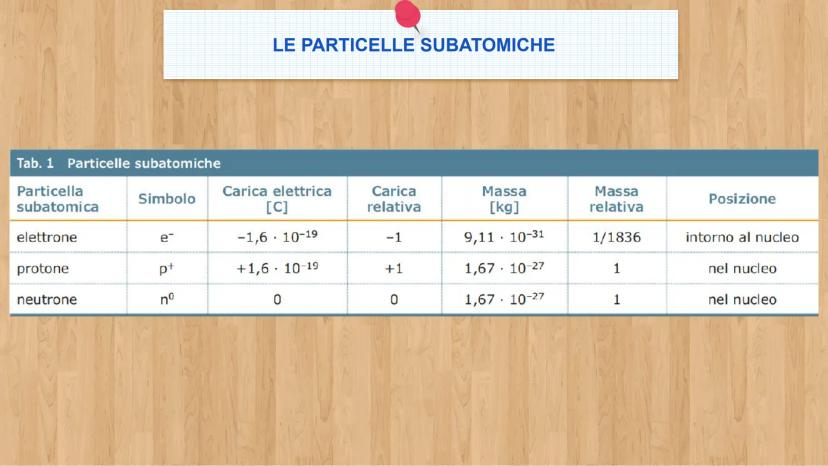
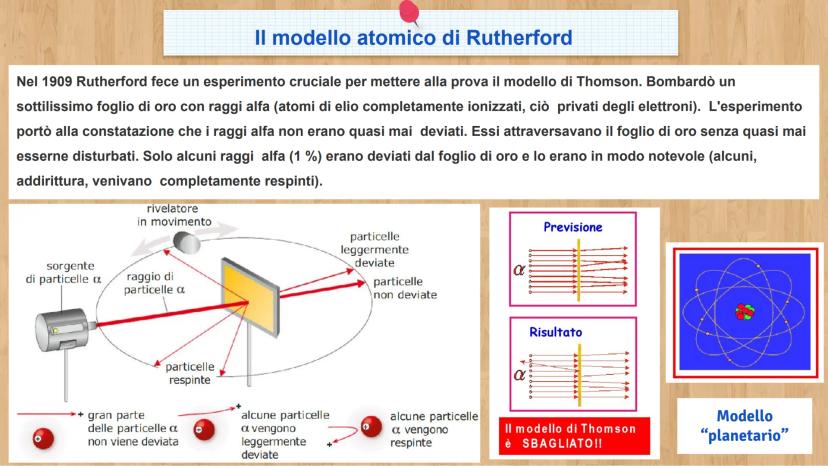
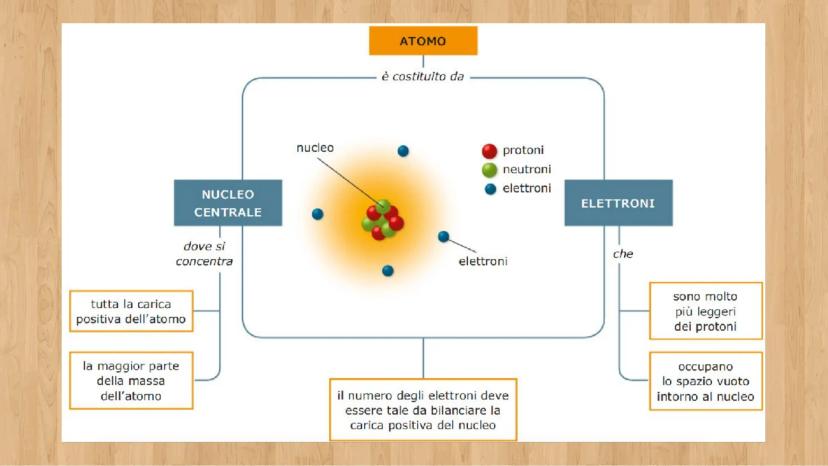
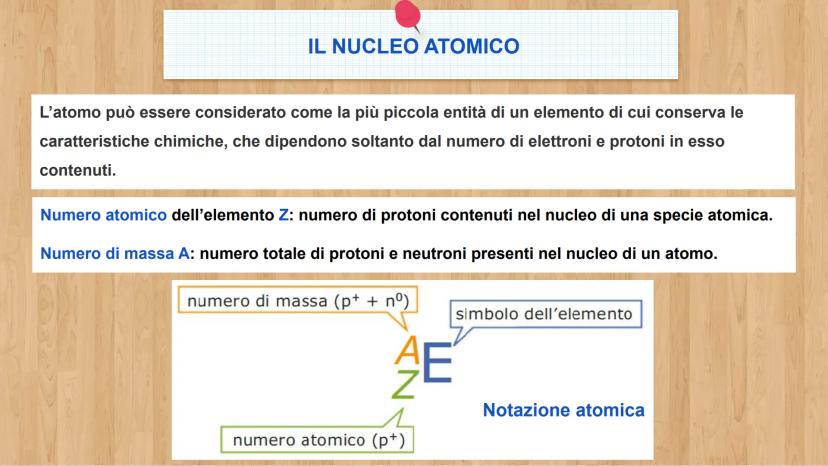
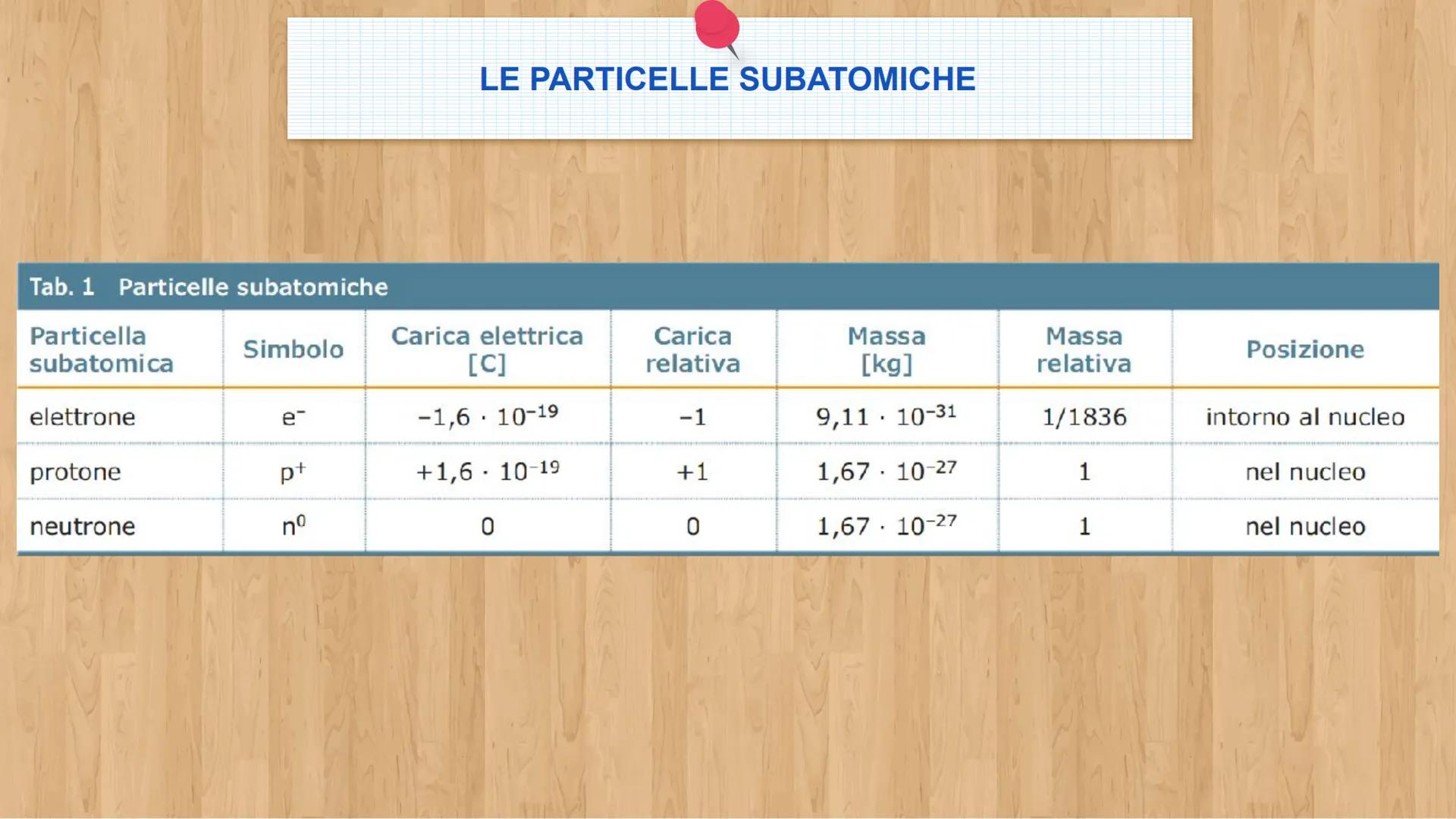
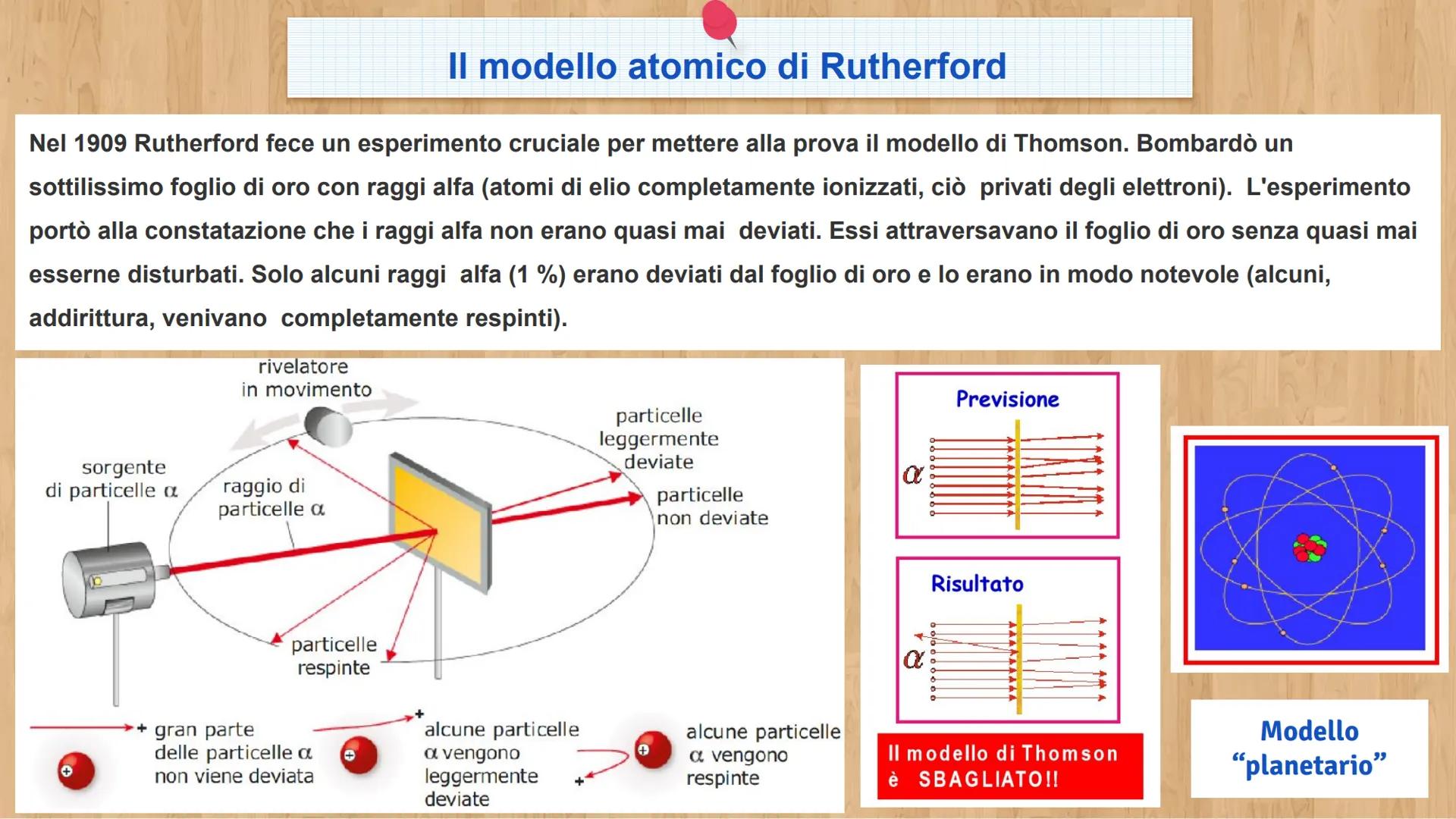
Le tre particelle fondamentali
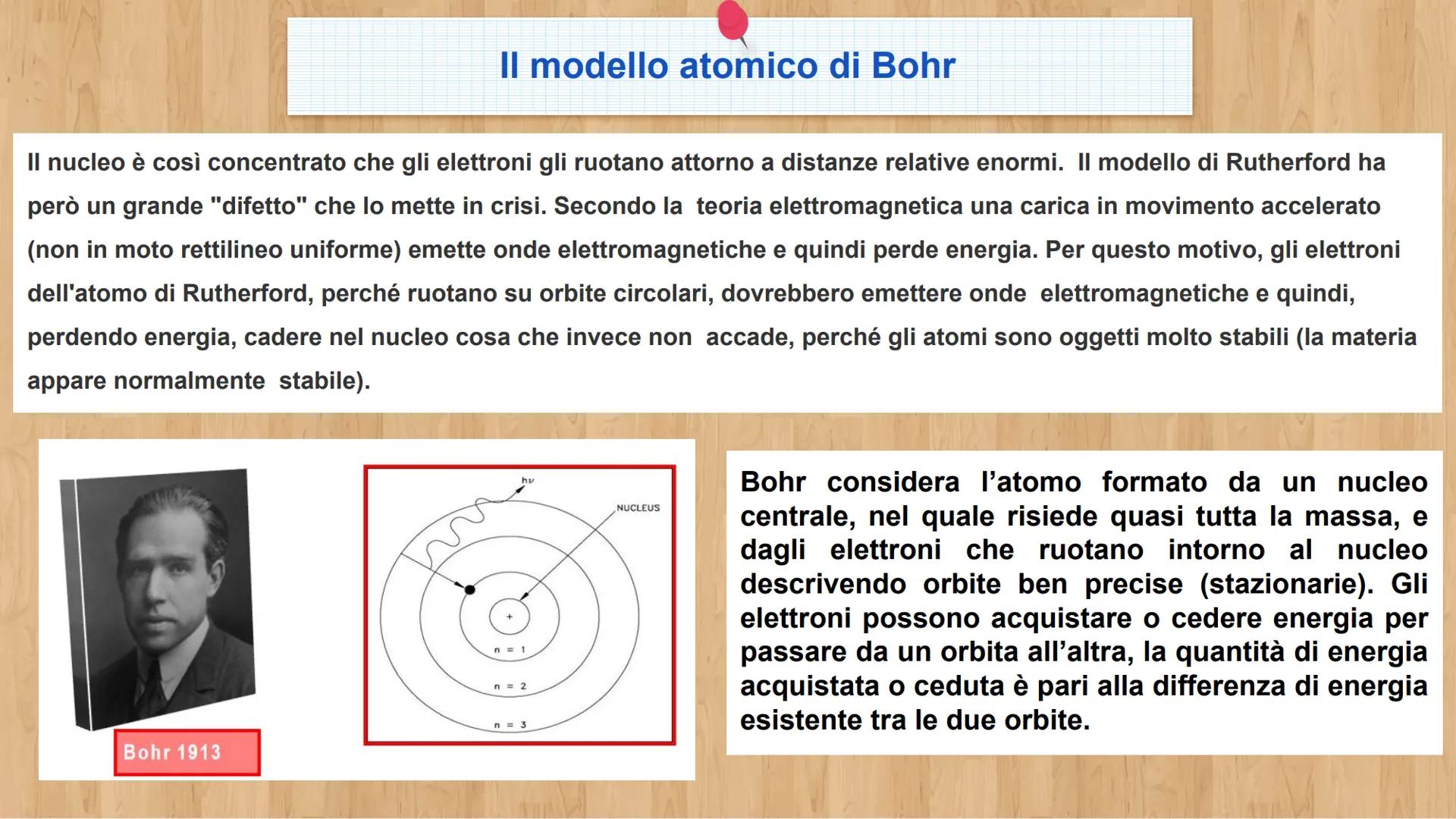
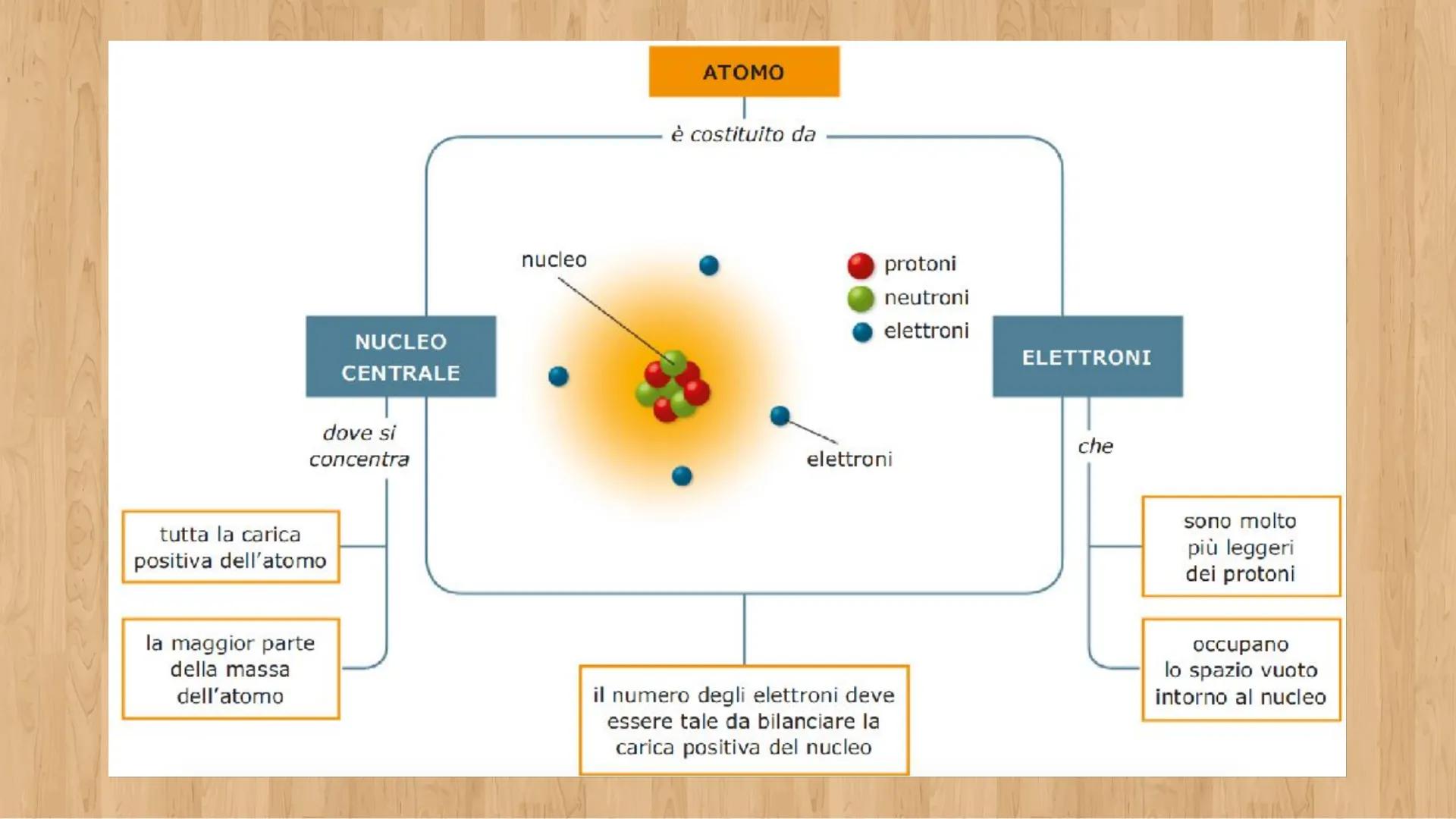
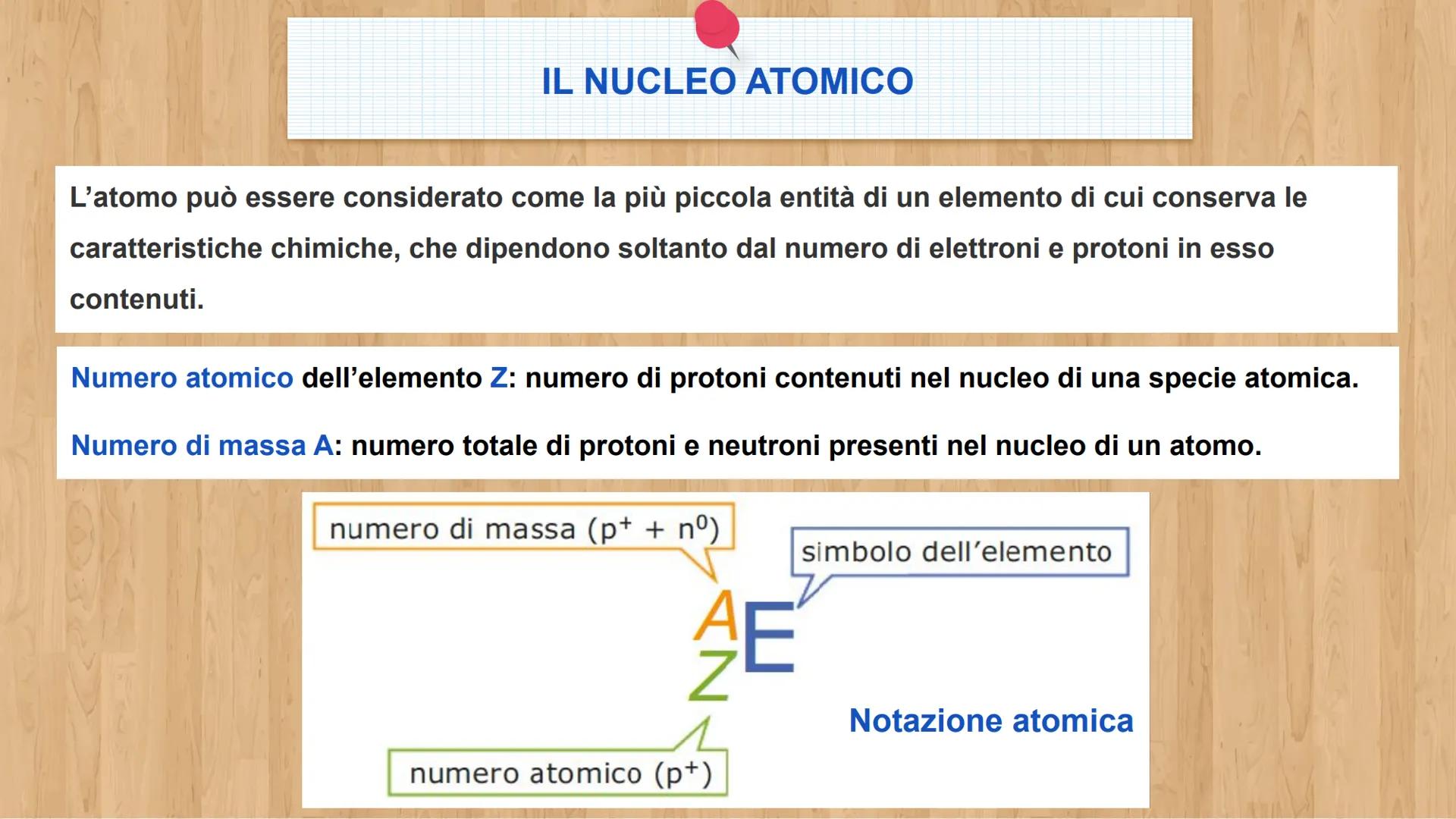
Ogni atomo è fatto di tre tipi di particelle, come una ricetta con tre ingredienti base. Conoscere le loro caratteristiche ti aiuterà a capire come funziona la materia!
Gli elettroni e− sono particelle negative leggerissime. Hanno carica -1,6 × 10⁻¹⁹ C e massa di soli 9,1 × 10⁻³¹ kg. Sono come piccole nuvole che si muovono velocissime intorno al centro dell'atomo.
I protoni p+ sono particelle positive molto più pesanti degli elettroni - ben 1836 volte di più! Hanno carica +1,6 × 10⁻¹⁹ C e massa 1,67 × 10⁻²⁷ kg. I neutroni (n°) hanno la stessa massa dei protoni ma sono neutri, senza carica elettrica.
💡 Trucco per ricordare: Protone = Positivo, Elettrone = nEgativo, Neutrone = Neutrale!