Legame Covalente Polare
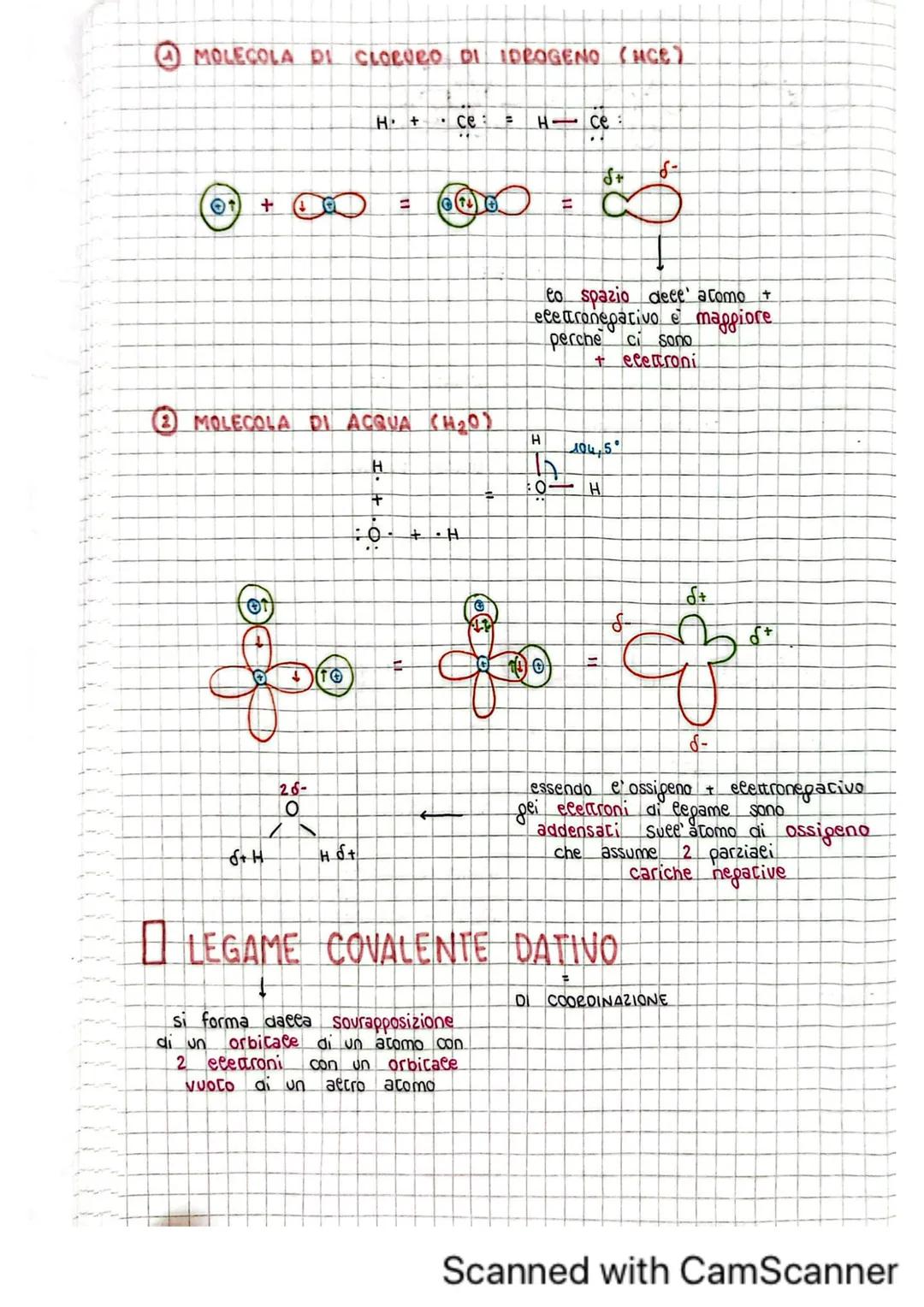
Nel legame covalente eteropolare (o polare), la differenza di elettronegatività è significativa (0,4 < ΔE < 1,9). Gli elettroni di legame sono più attratti dall'atomo più elettronegativo, creando una distribuzione asimmetrica della carica elettrica.
L'atomo più elettronegativo assume una parziale carica negativa (δ-), mentre quello meno elettronegativo assume una parziale carica positiva (δ+). Si forma così un dipolo: due cariche uguali e opposte separate da una certa distanza.
Nell'acido cloridrico (HCl), il cloro è più elettronegativo dell'idrogeno, quindi attrae maggiormente gli elettroni. Nell'acqua (H₂O), l'ossigeno è più elettronegativo dell'idrogeno, creando due dipoli che danno alla molecola la sua caratteristica polarità.
La polarità delle molecole influenza moltissime proprietà fisiche e chimiche, come la solubilità e i punti di ebollizione.
Curiosità: La polarità dell'acqua è il motivo per cui può sciogliere il sale ma non l'olio!