Ibridazione del Carbonio: Dal Teorico al Pratico
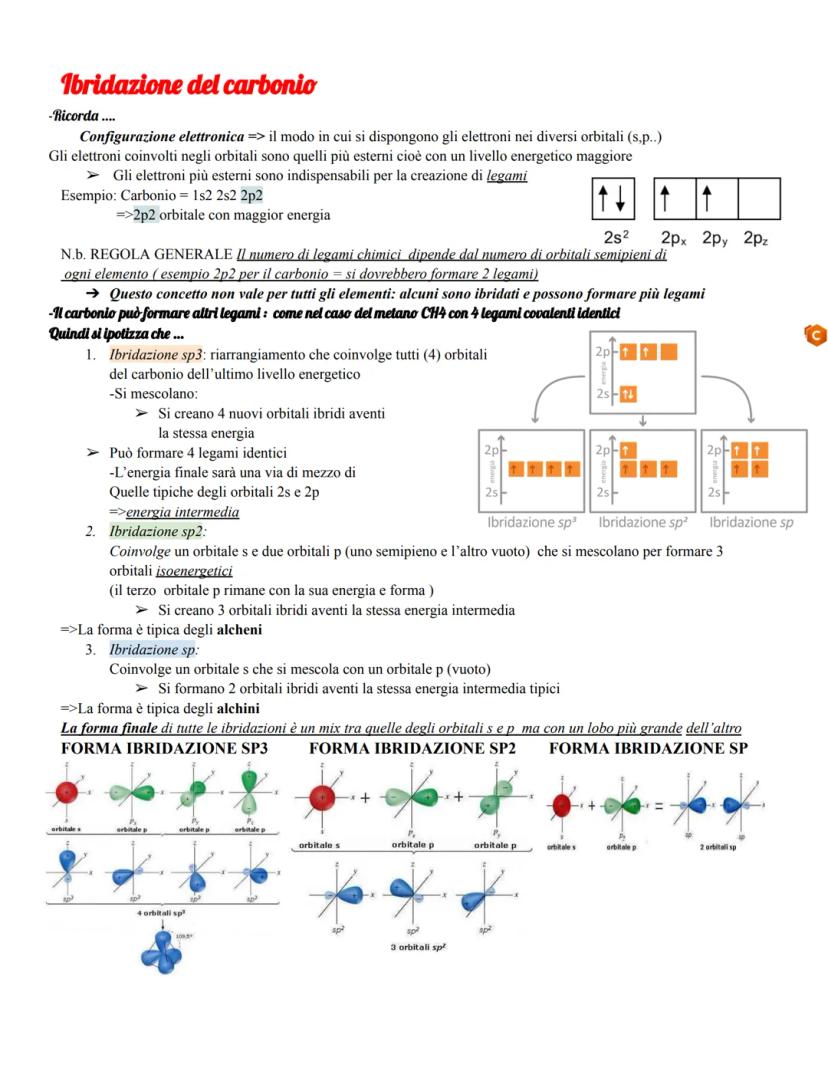
La configurazione elettronica del carbonio è 1s² 2s² 2p², quindi dovrebbe formare solo due legami. Ma come mai nel metano ne forma quattro identici? La risposta sta nell'ibridazione.
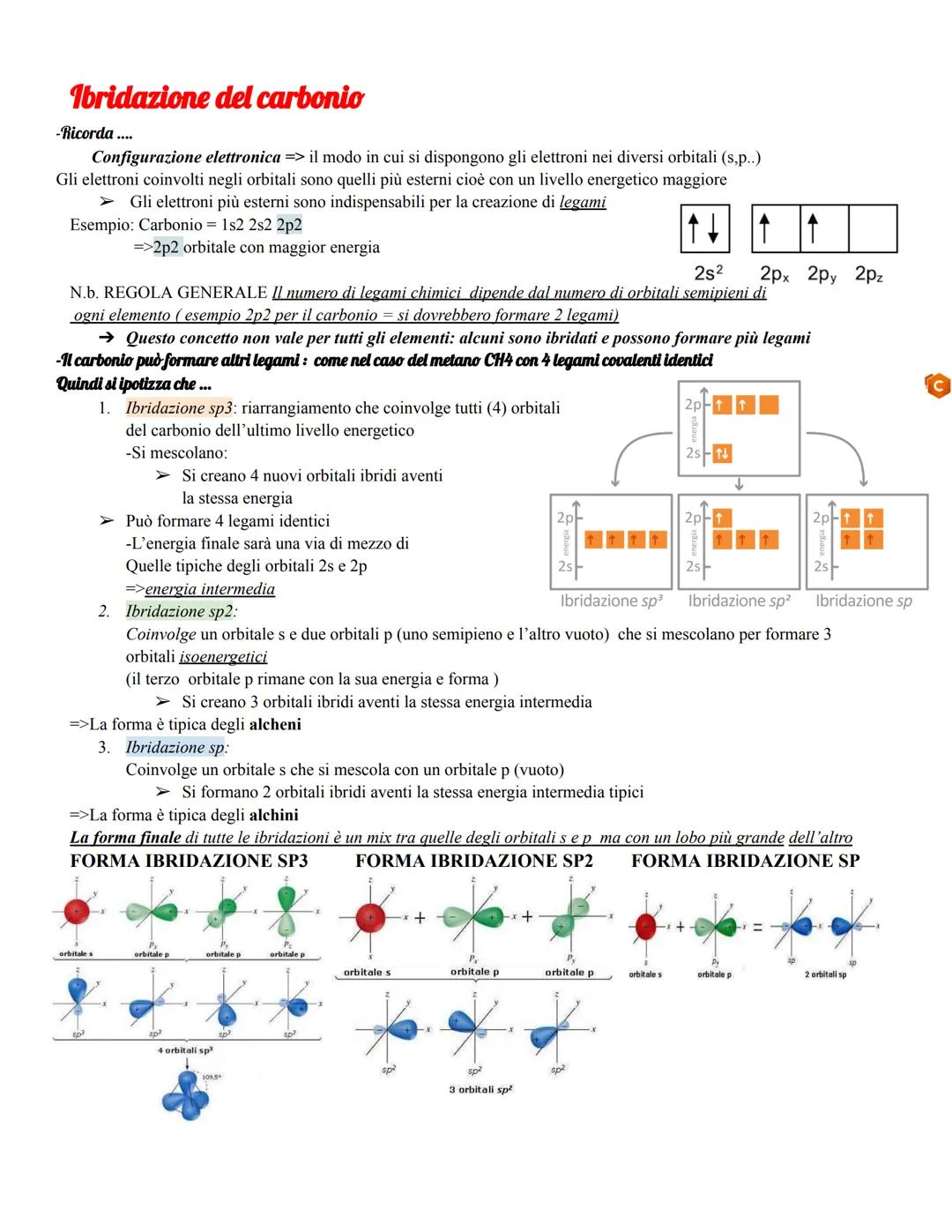
Nell'ibridazione sp³, l'orbitale 2s si mescola con tutti e tre gli orbitali 2p, creando quattro orbitali ibridi identici con energia intermedia. Questo spiega perfettamente i quattro legami del metano con geometria tetraedrica.
L'ibridazione sp² coinvolge un orbitale s e due orbitali p, lasciando un orbitale p puro che può formare legami π. L'ibridazione sp usa solo un orbitale s e un orbitale p, lasciando due orbitali p puri per formare due legami π.
La forma finale degli orbitali ibridi è sempre asimmetrica, con un lobo più grande dell'altro - questo favorisce la sovrapposizione e rende i legami più forti.
Visualizza così: Immagina gli orbitali come palloncini che si "mescolano" per creare nuove forme più efficienti per legarsi!