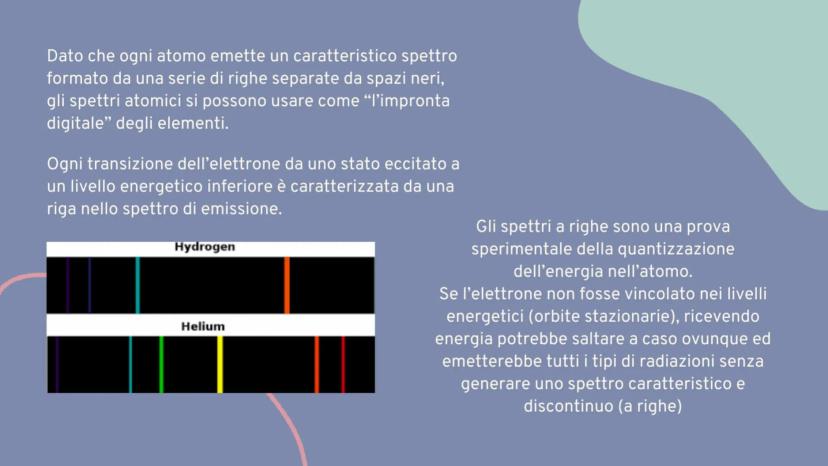
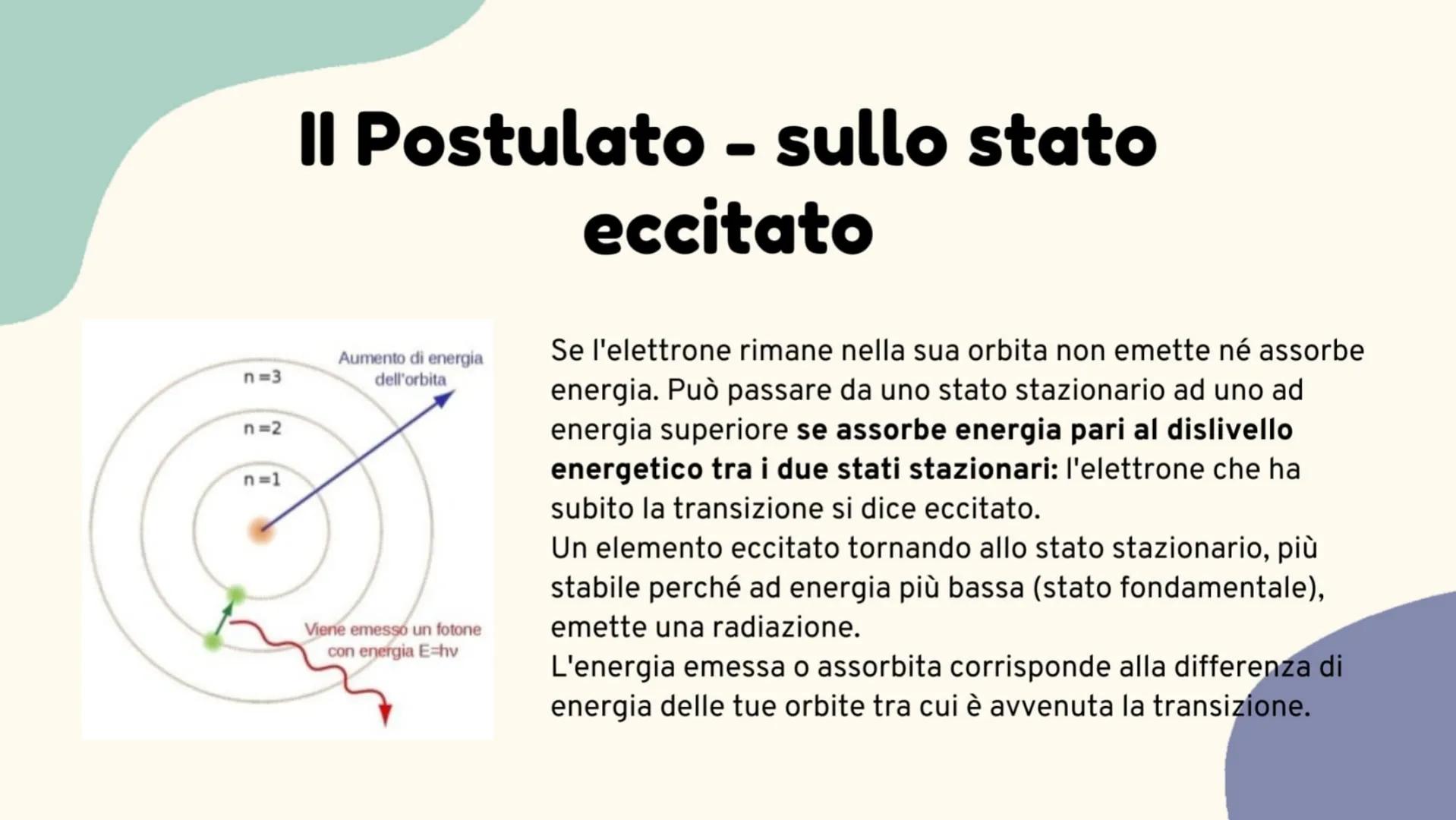
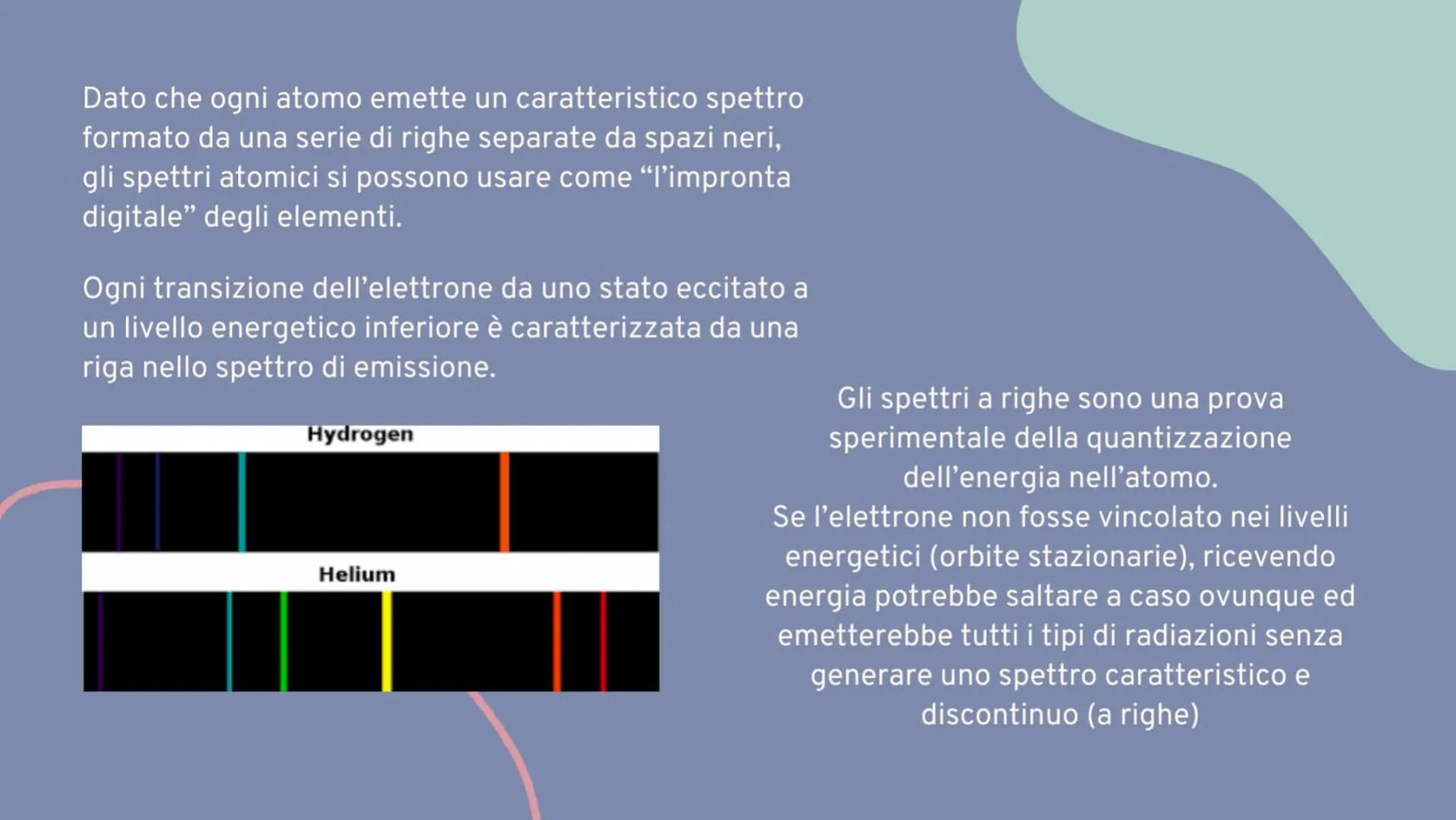
Spettri a righe
Gli atomi di diversi elementi in fase gassosa, quando vengono riscaldati, emettono luce che può essere analizzata con un prisma. Il risultato è sorprendente: otteniamo spettri a righe, completamente diversi dagli spettri continui.
Questi spettri atomici di emissione sono discontinui, formati da righe colorate separate da spazi neri. Ogni elemento chimico produce il suo spettro caratteristico, come un codice a barre univoco.
L'idrogeno, per esempio, mostra righe a 656 nm (rossa), 486 nm verde−blu, 434 nm (viola) e 410 nm (violetta). Queste righe corrispondono a transizioni elettroniche specifiche.
💡 Applicazione: Gli investigatori forensi usano questa tecnica per identificare sostanze sconosciute sulla scena del crimine!