Regole Pratiche e Trucchi
Quando mescoli due liquidi, il volume totale è sempre leggermente minore della somma dei volumi originali. Le forze di attrazione tra le molecole le fanno avvicinare, riducendo il volume complessivo!
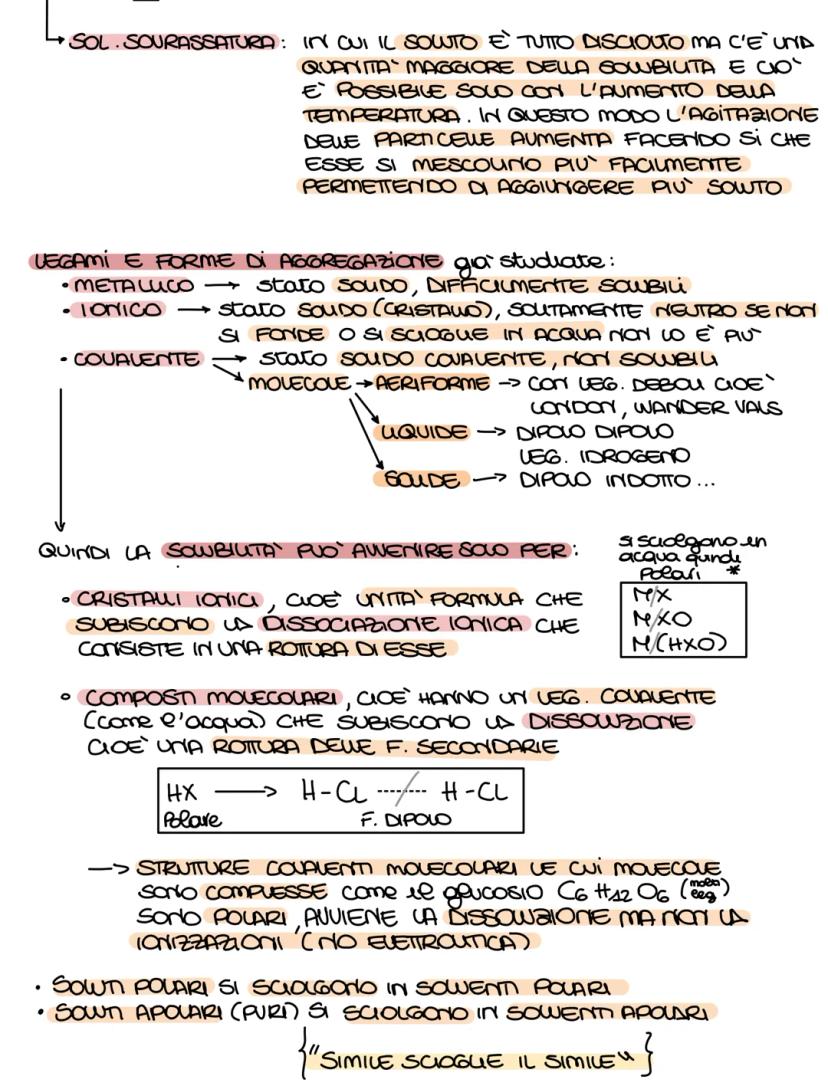
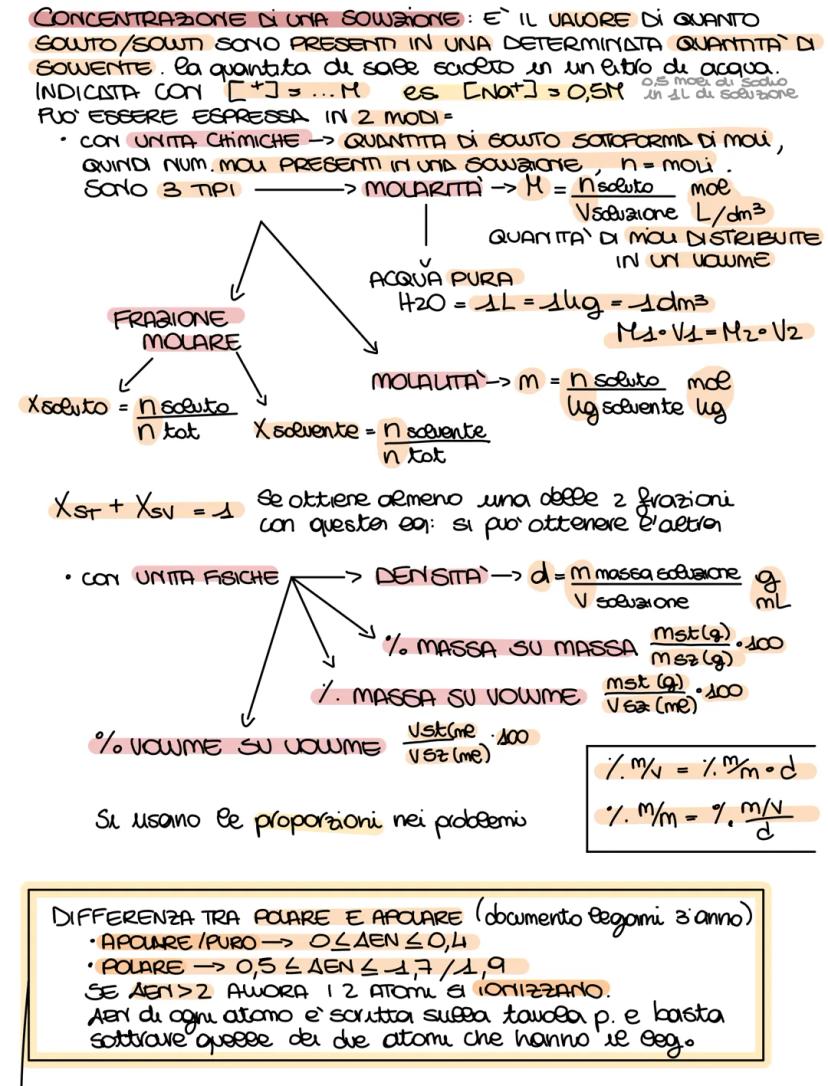
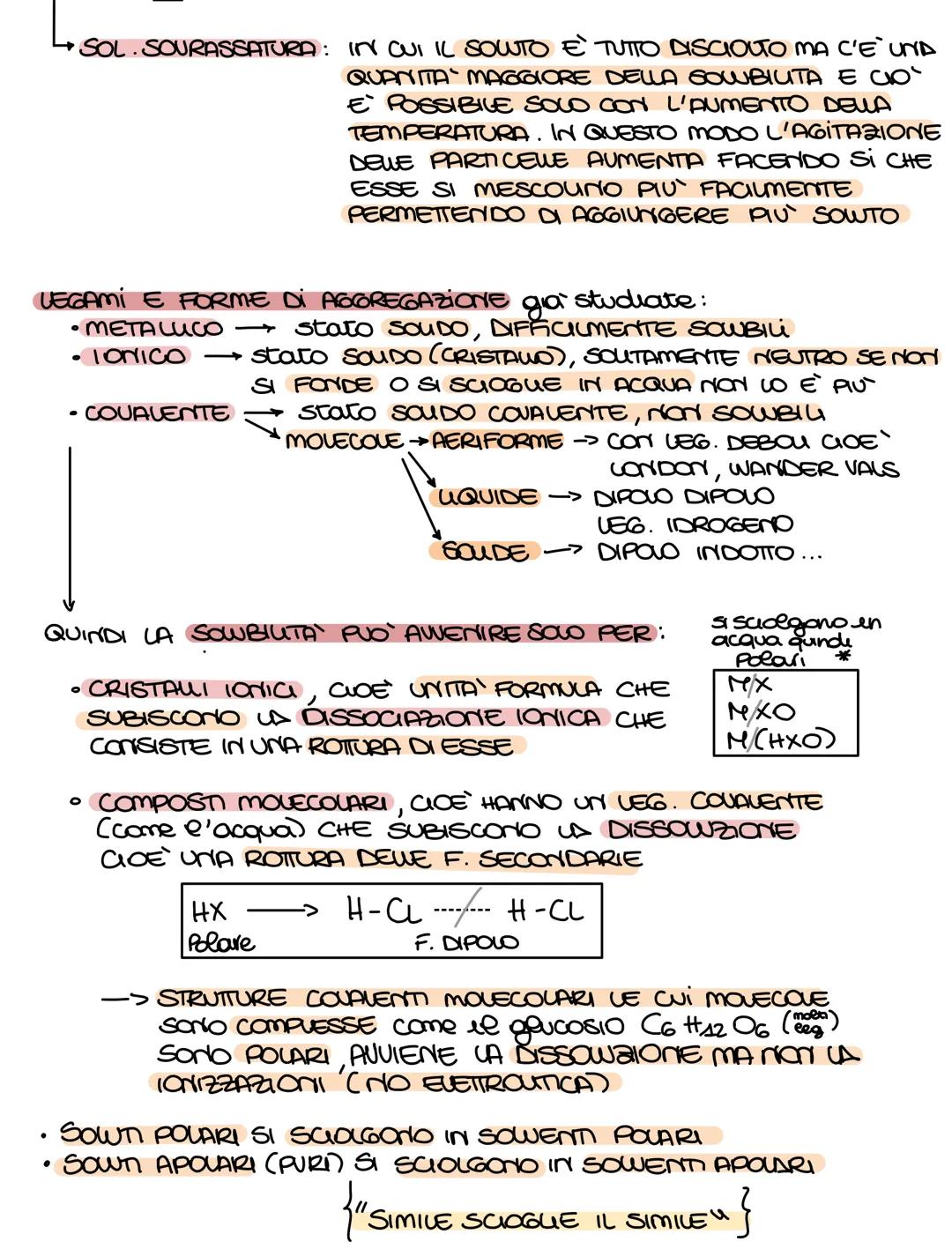
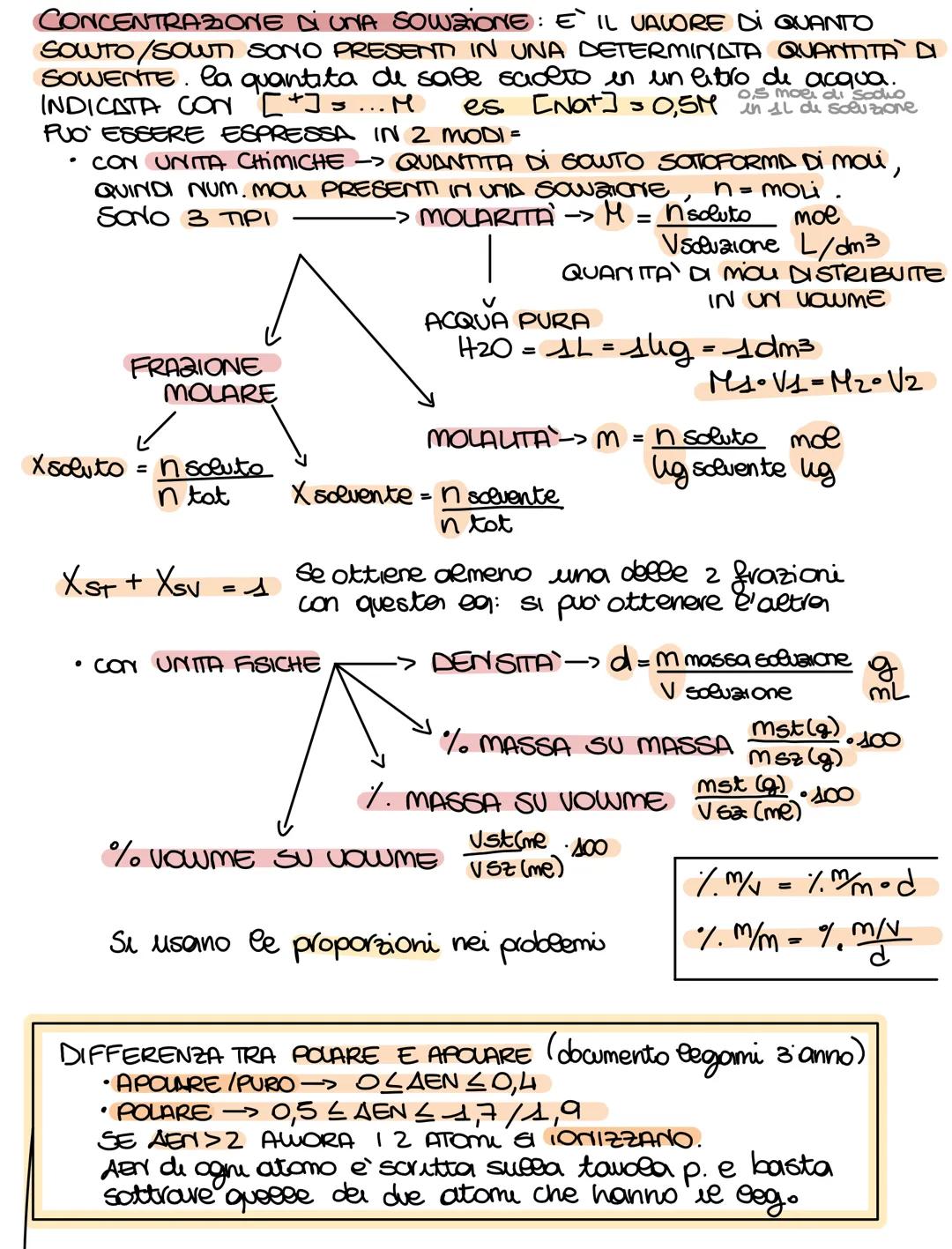
Per capire se un composto si scioglie in acqua, guarda il tipo di legame. I composti ionici metallo+non−metallo si sciolgono quasi sempre. Per i composti molecolari, calcola la differenza di elettronegatività (ΔEN): se è tra 0,5 e 1,9 è polare e si scioglie.
Ricorda le regole di solubilità: soluzioni ioniche e molecolari polari si sciolgono in solventi polari, mentre le molecolari apolari si sciolgono in solventi apolari. La massa molecolare si calcola sommando le masse atomiche di tutti gli atomi.
Se due soluzioni hanno stessa molarità ma volumi diversi, quando le mescoli la molarità finale rimane uguale. È come mescolare due bicchieri di tè con la stessa dolcezza!
💡 Formula salvavita: n(mol) = massa(g) / massa molareg/mol. Questa ti risolve il 90% degli esercizi!