Legami Chimici: Classificazione e Proprietà
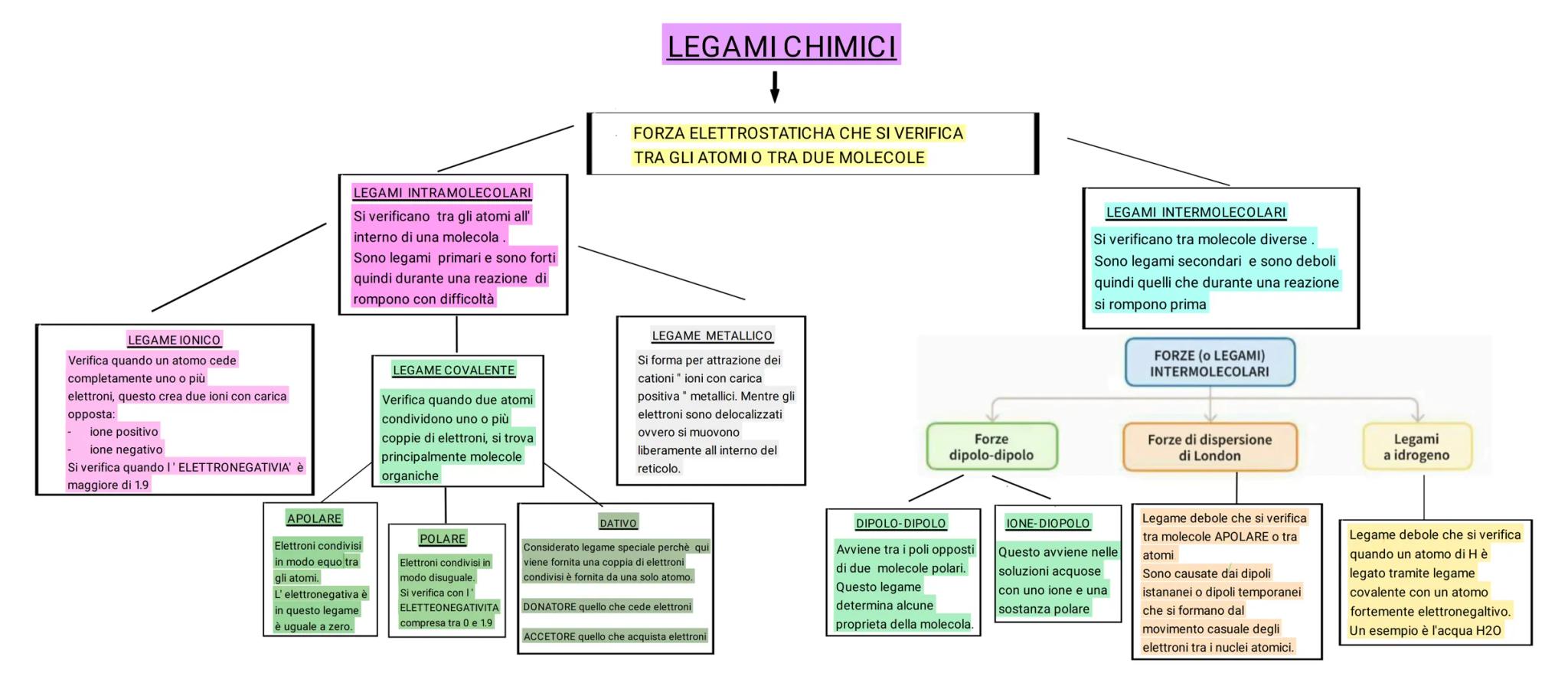
I legami chimici sono forze elettrostatiche che si verificano tra atomi o molecole e possono essere classificati in due grandi categorie. I legami intramolecolari sono legami primari forti che si formano tra atomi all'interno della stessa molecola e sono difficili da rompere durante una reazione. I legami intermolecolari, invece, sono legami secondari deboli che uniscono molecole diverse e si rompono più facilmente.
Tra i legami intramolecolari troviamo il legame ionico, che si forma quando un atomo cede completamente elettroni creando ioni di carica opposta (positiva e negativa). Questo accade quando la differenza di elettronegatività è maggiore di 1,9. Il legame covalente si verifica quando due atomi condividono coppie di elettroni e può essere di tre tipi: apolare (elettroni condivisi equamente), polare (elettroni condivisi in modo disuguale con elettronegatività tra 0 e 1,9) e dativo (in cui la coppia di elettroni proviene da un solo atomo). Il legame metallico si forma per attrazione tra cationi metallici con elettroni che si muovono liberamente nel reticolo.
I legami intermolecolari comprendono le forze dipolo-dipolo tra molecole polari, le forze ione-dipolo nelle soluzioni acquose, le forze di dispersione di London (legami deboli tra molecole apolari causati da dipoli temporanei) e i legami a idrogeno, che si formano quando l'idrogeno è legato a un atomo fortemente elettronegativo come nell'acqua.
💡 Nota importante: La forza dei legami influenza direttamente le proprietà fisiche delle sostanze come i punti di ebollizione e fusione. Più forti sono i legami, maggiore sarà l'energia necessaria per romperli!