L'Ibridazione degli Orbitali
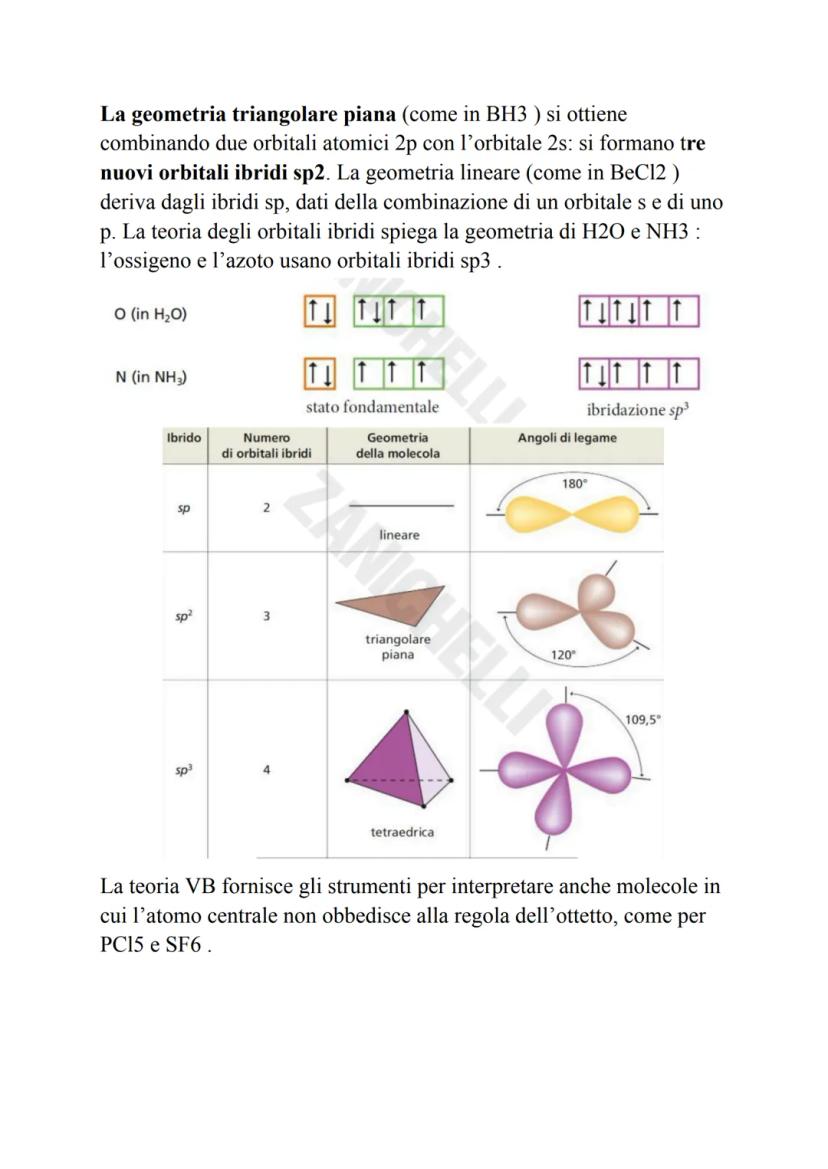
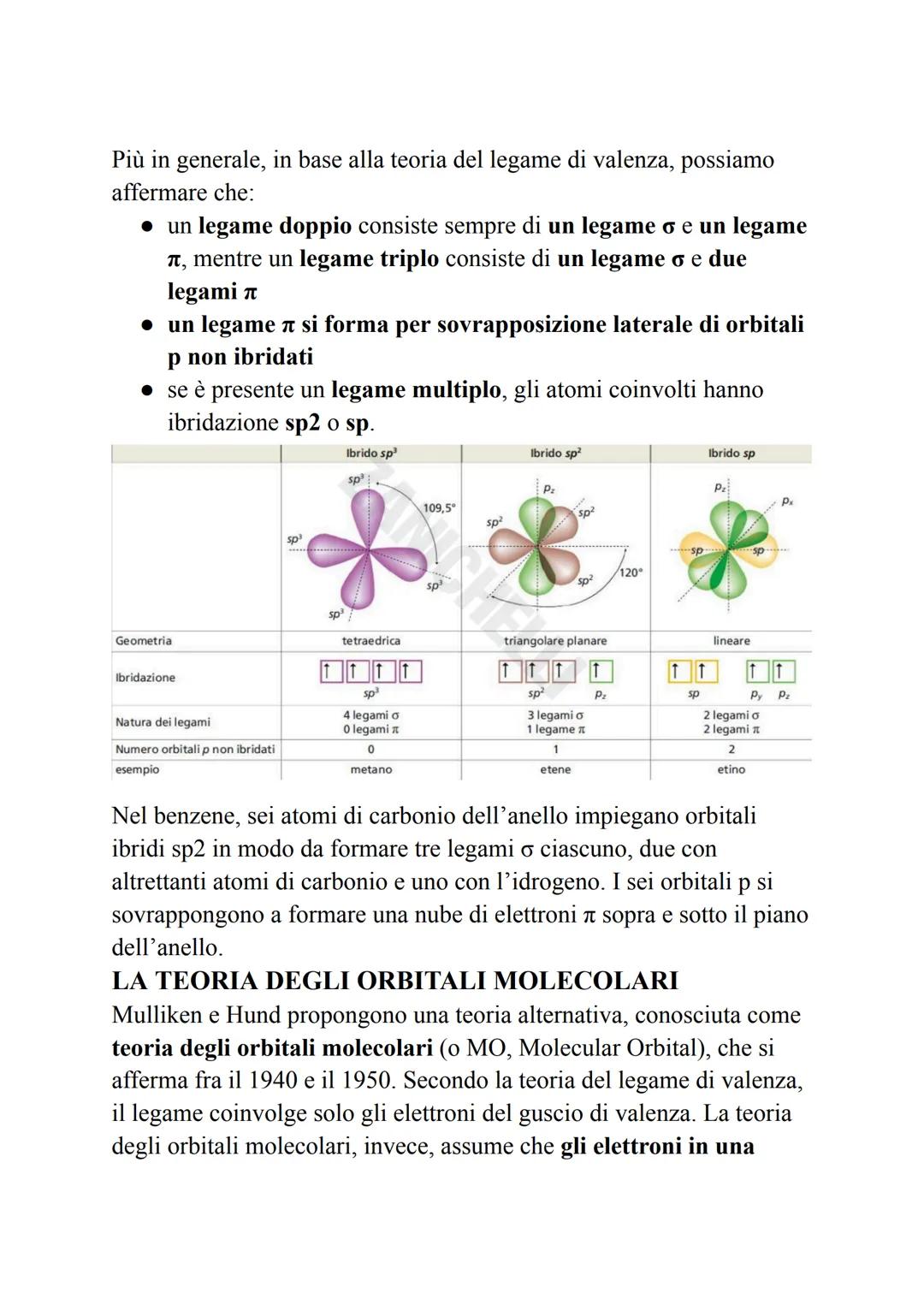
Per spiegare la geometria delle molecole, Pauling propone il concetto di orbitali ibridi. Questi si formano mescolando orbitali atomici con energie simili, creando nuovi orbitali con orientazioni specifiche.
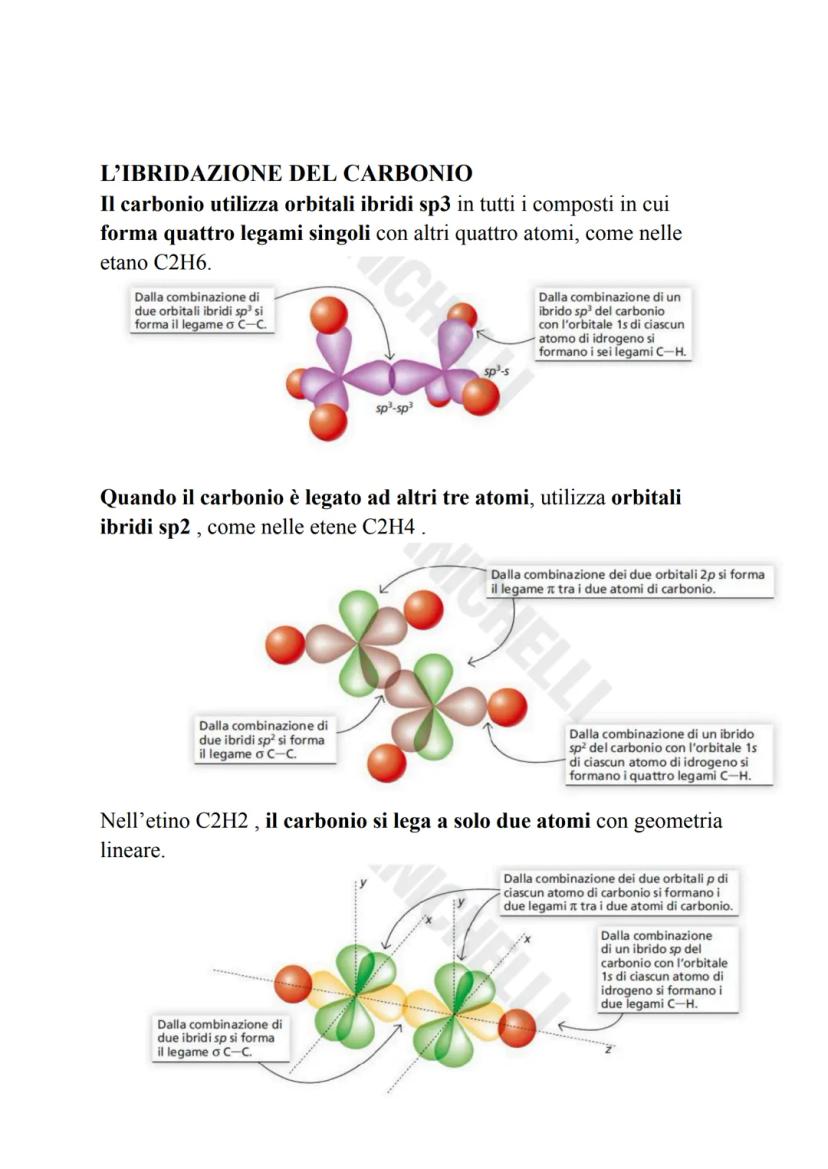
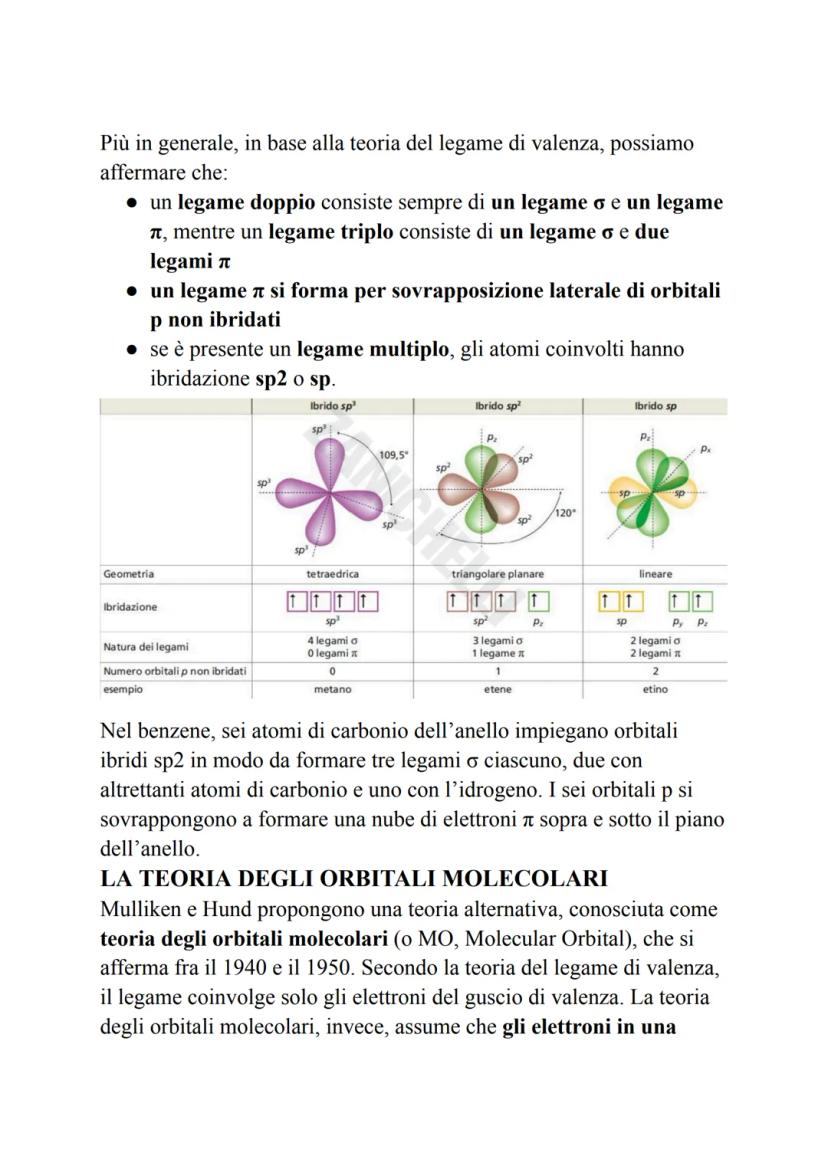
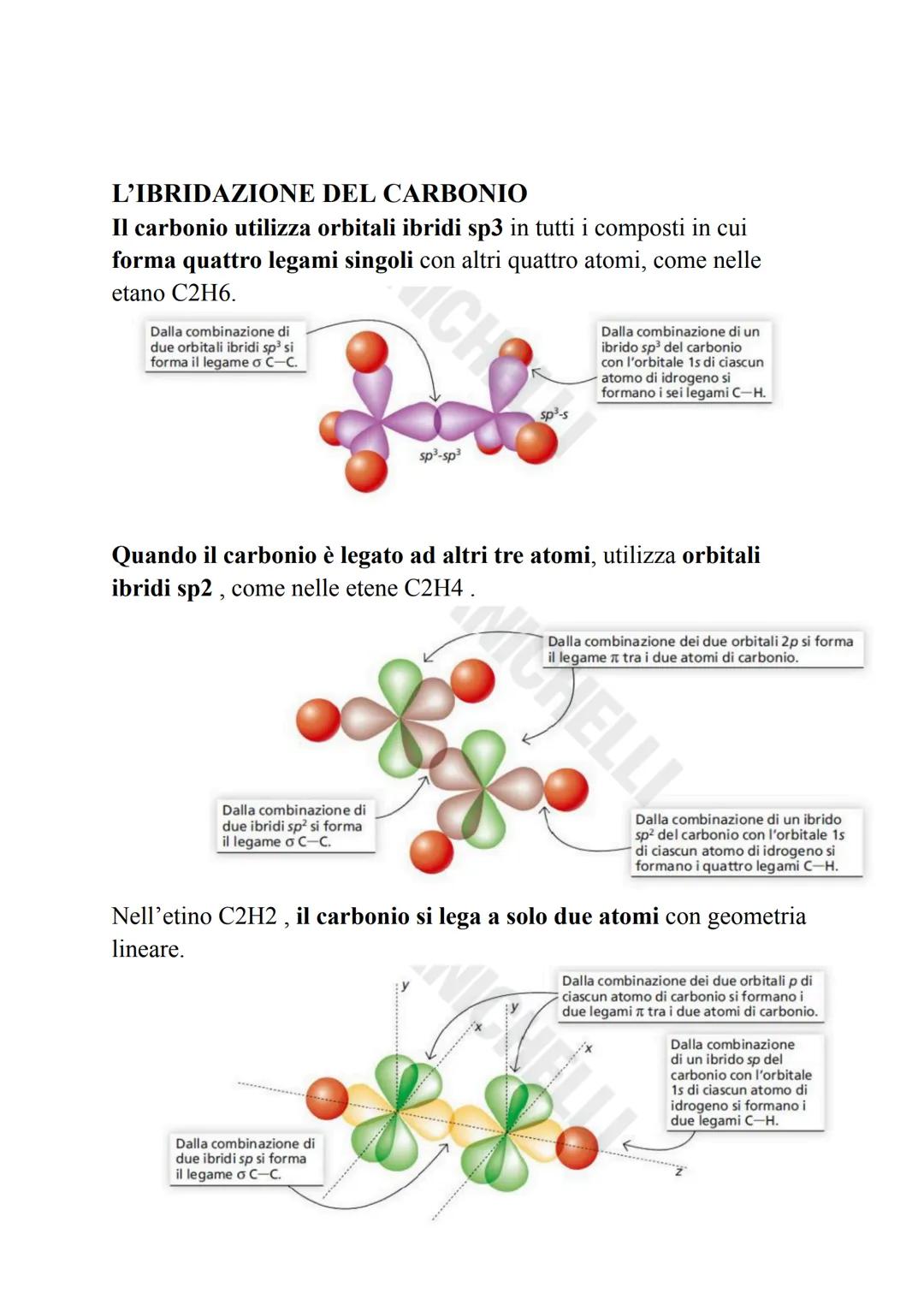
Il carbonio è il maestro dell'ibridazione! I suoi orbitali s e p si mescolano per creare tre tipi di ibridi: sp³ (tetraedrica, 109,5°), sp² (triangolare piana, 120°) e sp (lineare, 180°).
L'ibridazione sp³ spiega perché il metano ha una forma tetraedrica perfetta. L'ossigeno nell'acqua e l'azoto nell'ammoniaca usano anche loro orbitali sp³, ma la presenza di coppie elettroniche libere modifica leggermente gli angoli.
💡 Schema pratico: 4 legami = sp³, 3 legami = sp², 2 legami = sp
Questa teoria funziona anche per molecole che non seguono la regola dell'ottetto, come PCl₅ e SF₆.