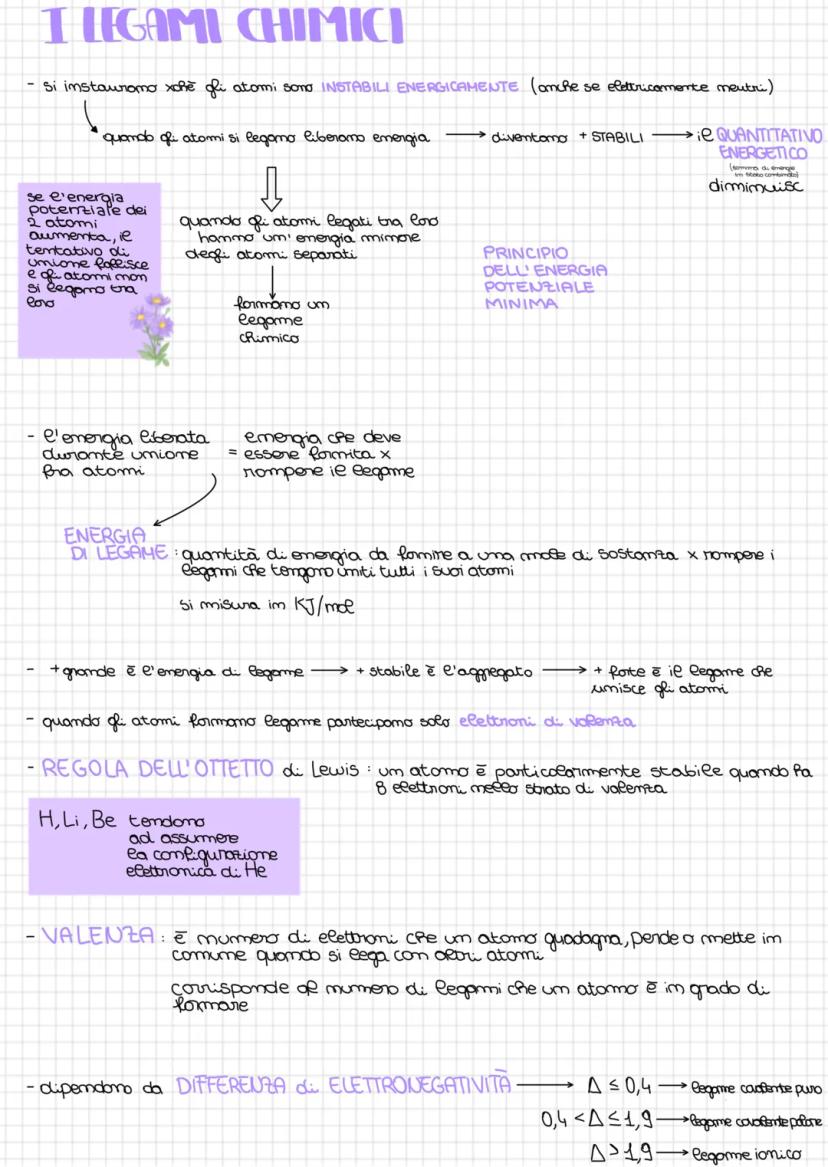
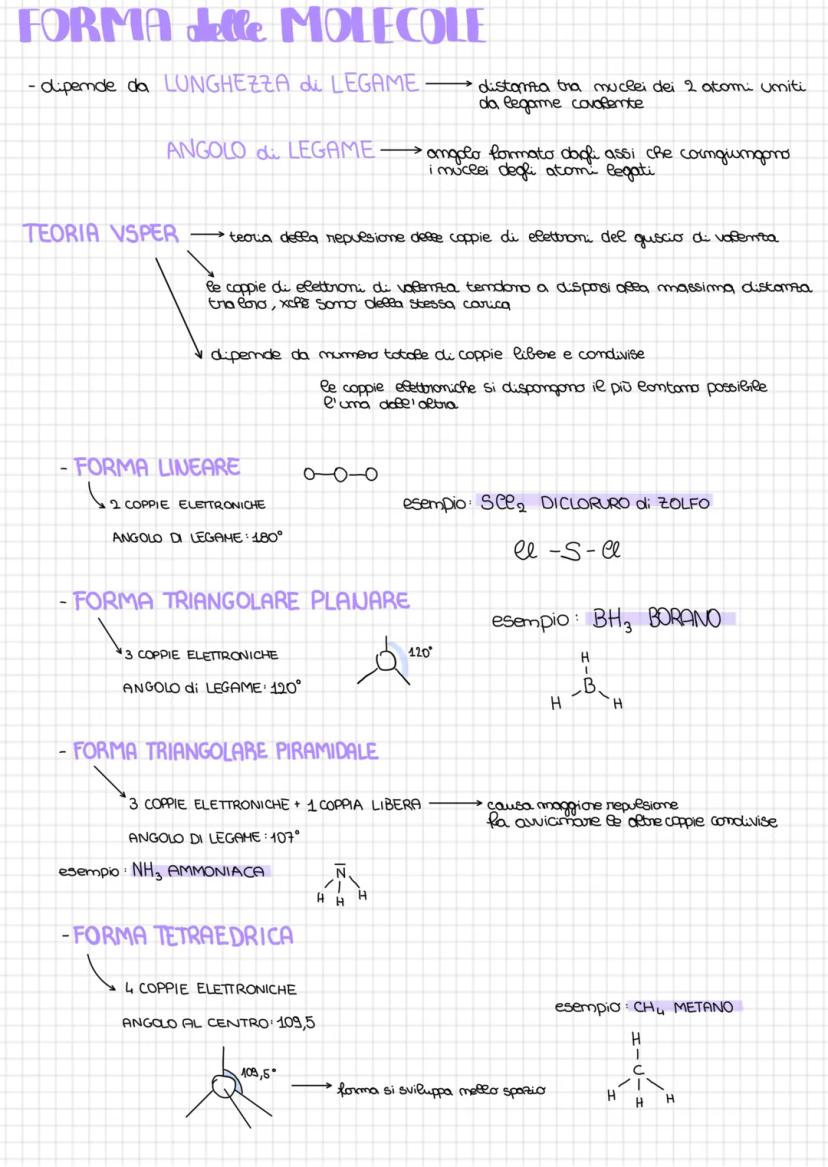
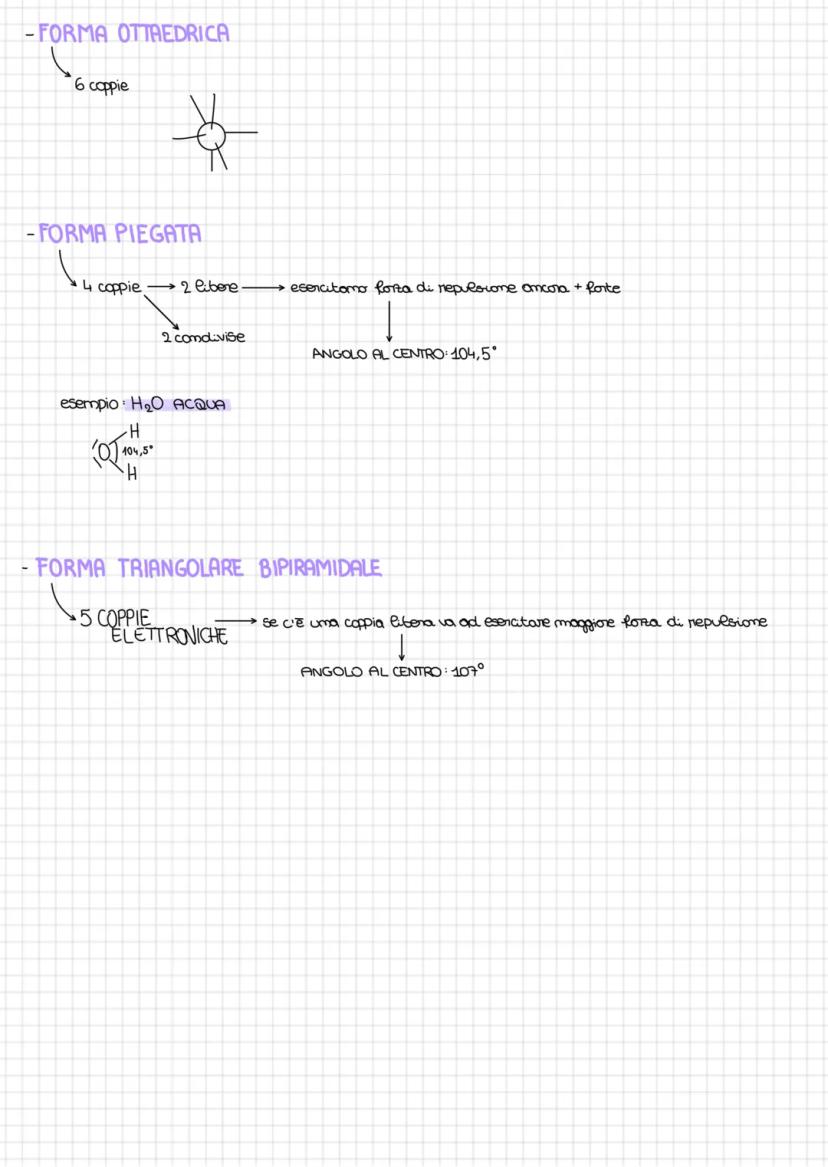
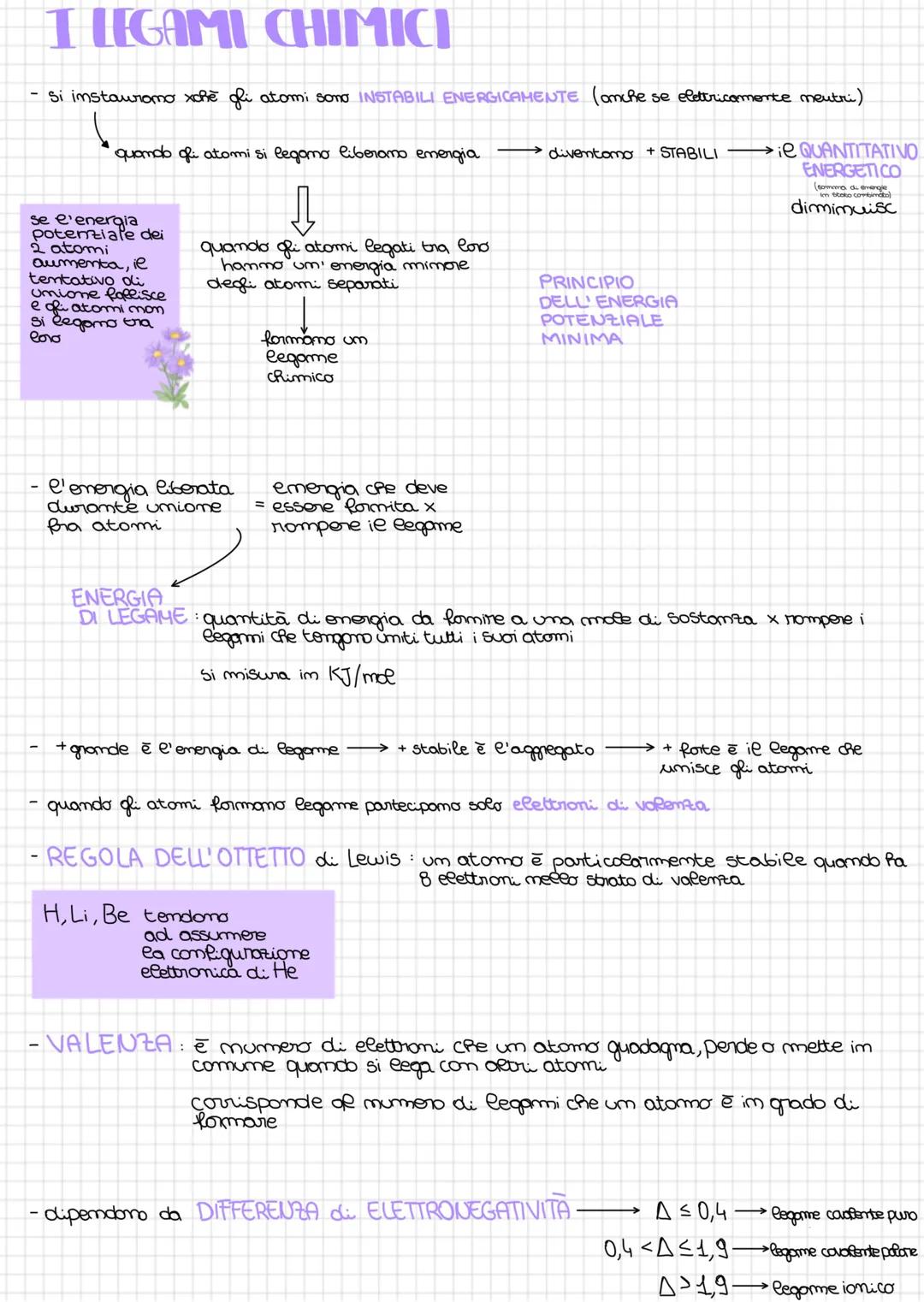
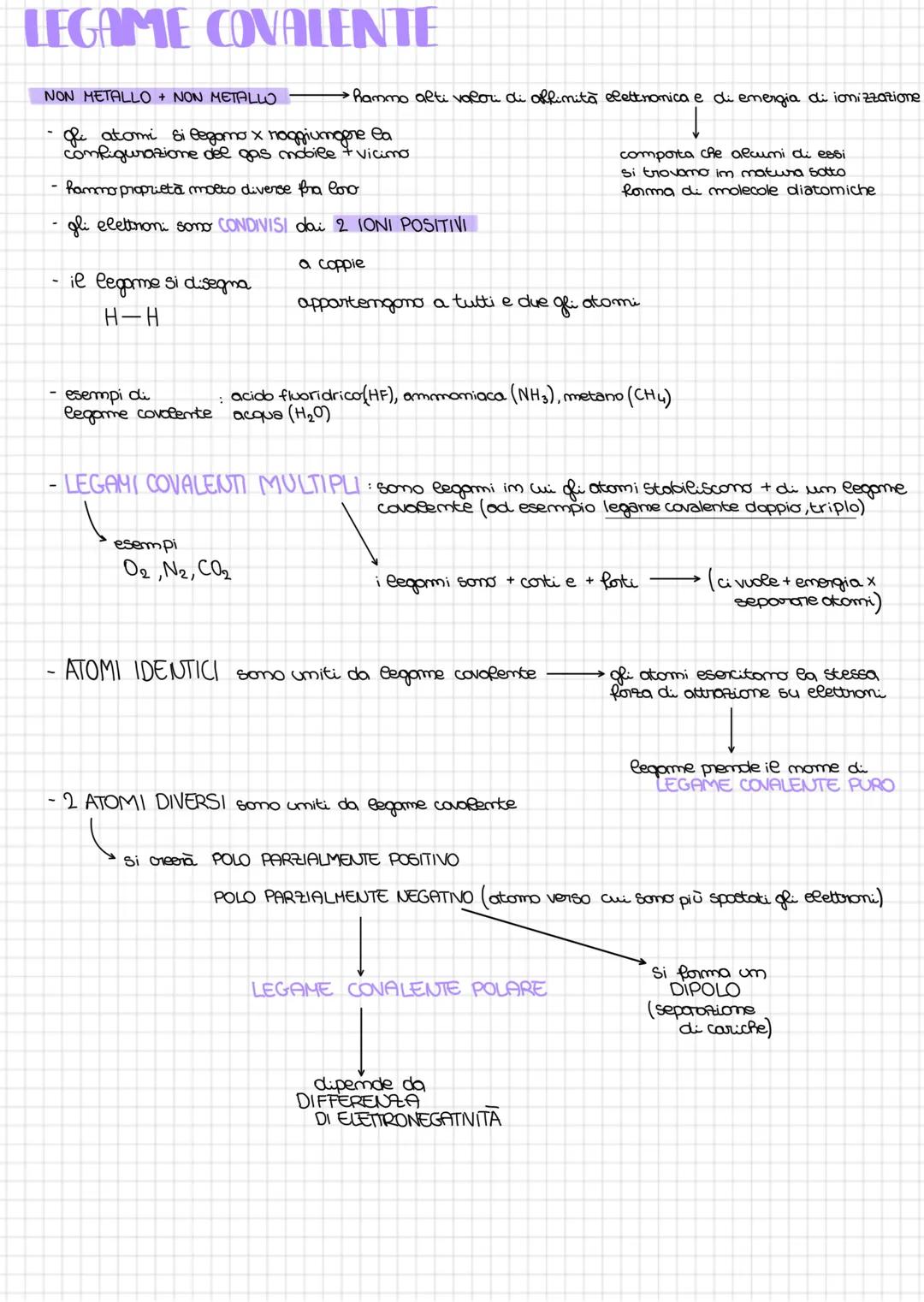
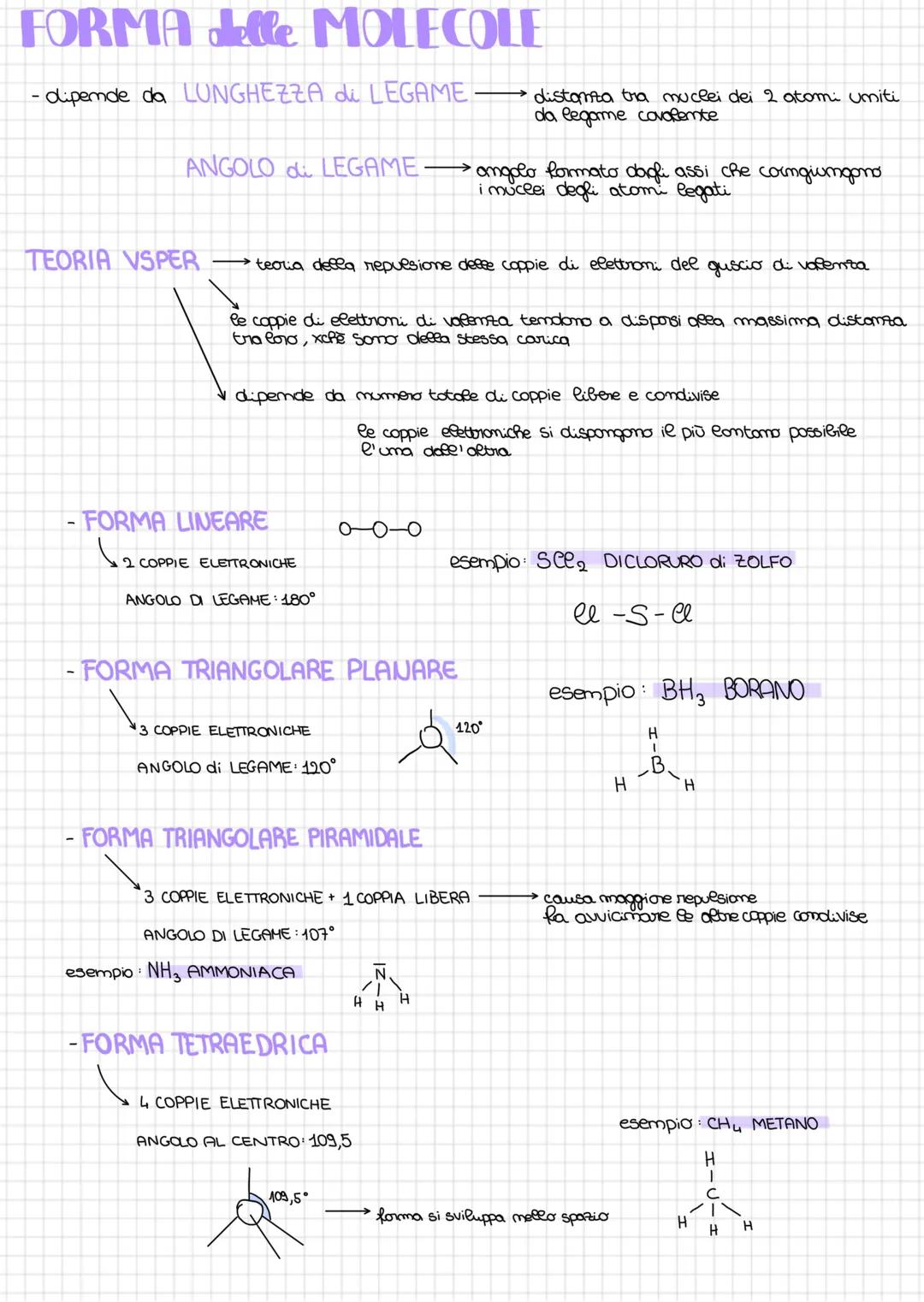
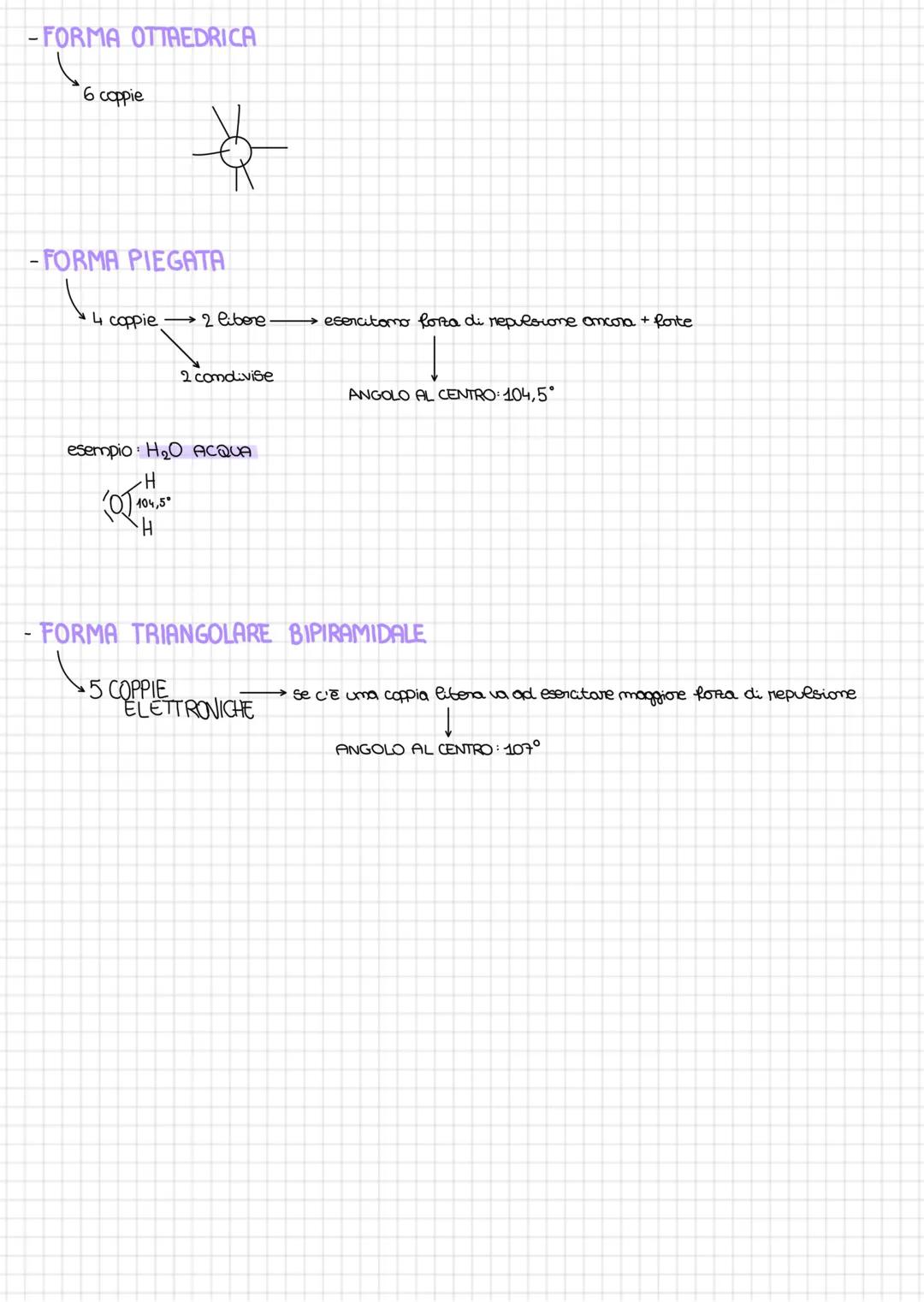
La Forma delle Molecole
Le molecole non sono piatte come le disegniamo sul foglio: hanno forme tridimensionali precise! La forma dipende dalla lunghezza di legame (distanza tra i nuclei) e dall'angolo di legame tra gli assi che collegano i nuclei.
La teoria VSEPR spiega tutto: le coppie di elettroni si respingono perché hanno la stessa carica, quindi si dispongono alla massima distanza possibile. È come persone che cercano di stare il più lontano possibile in una stanza!
Ecco le forme principali: lineare (2 coppie, 180°), triangolare piana (3 coppie, 120°), tetraedrica (4 coppie, 109,5°). L'ammoniaca (NH₃) ha forma piramidale (107°) perché ha una coppia libera che "spinge" di più.
L'acqua (H₂O) ha forma piegata con angolo di 104,5° perché le sue due coppie libere esercitano una repulsione extra forte sulle coppie condivise.
🏗️ Visualizza: Immagina gli elettroni come magneti con la stessa polarità che si respingono - questo ti aiuterà a capire le forme molecolari!