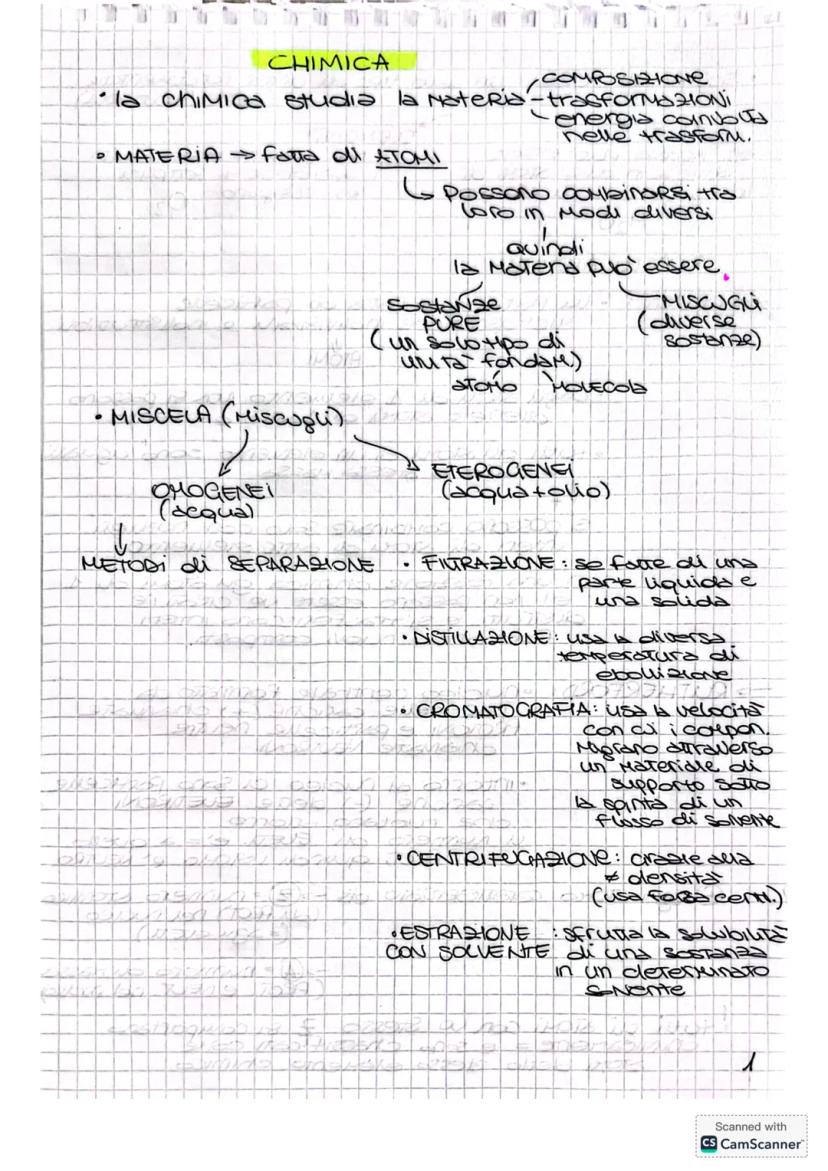
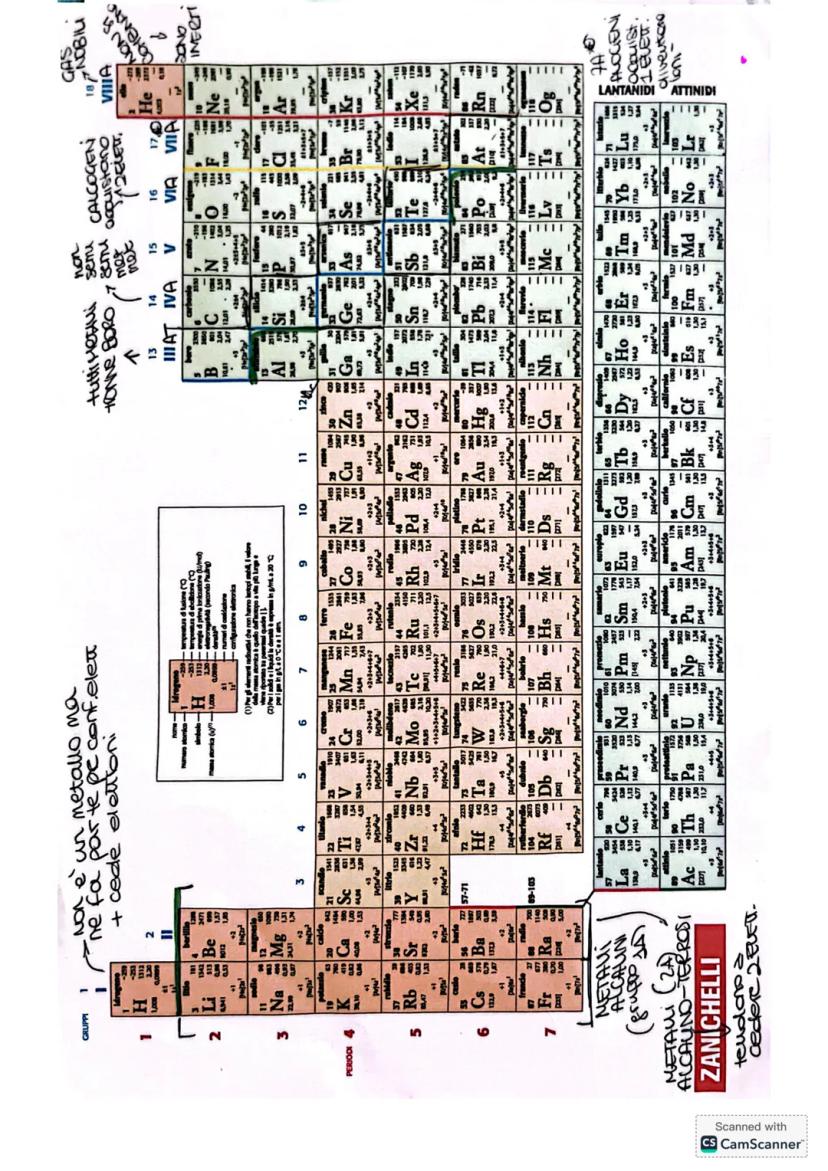
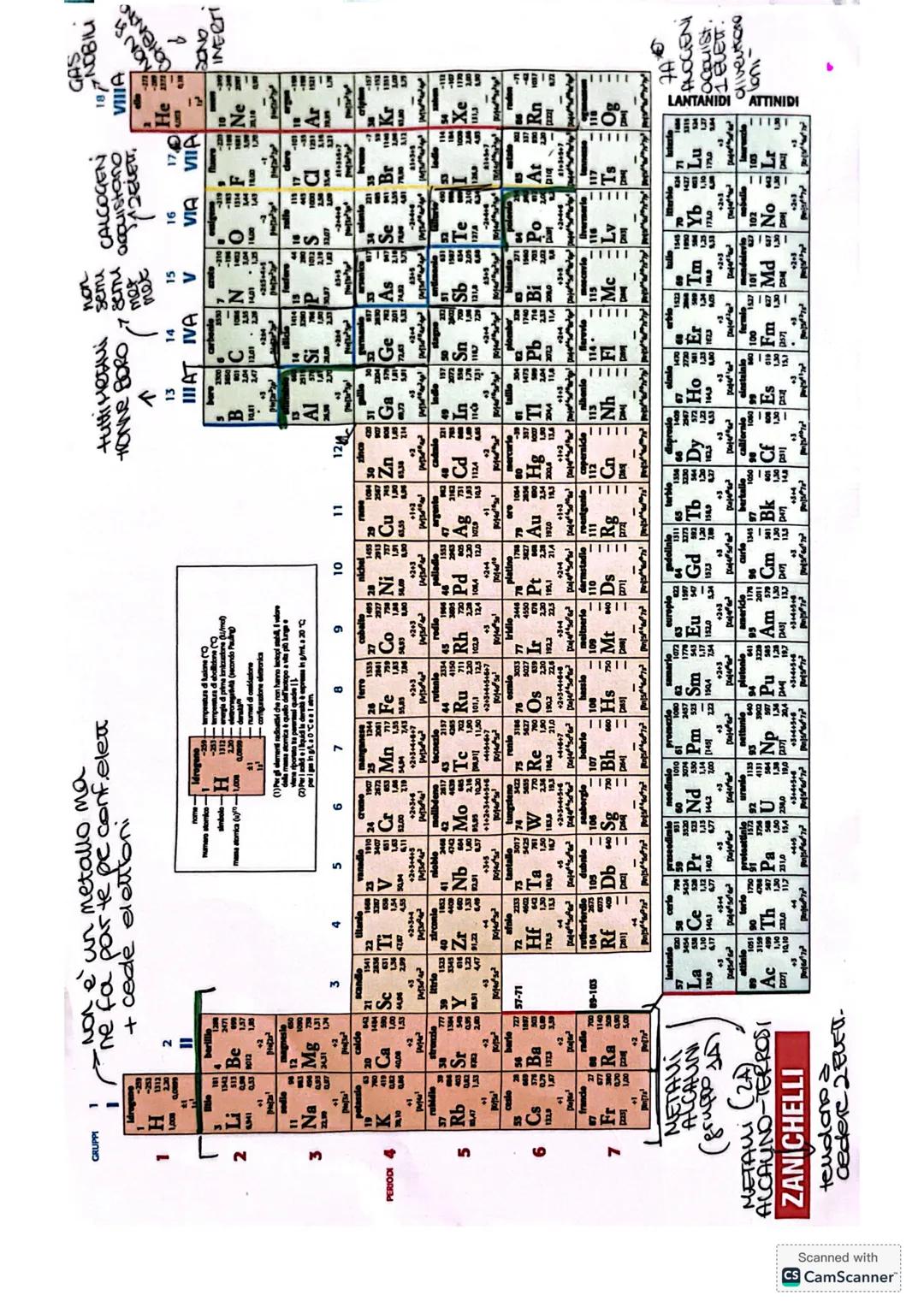
La Tavola Periodica - Struttura Base
La Tavola Periodica organizza tutti gli elementi in base alle loro proprietà. Le colonne verticali sono i gruppi (elementi con caratteristiche simili), le righe orizzontali sono i periodi (stesso numero di livelli elettronici).
La tavola si divide in tre zone principali: metalli a sinistra, non metalli a destra, e semimetalli lungo la linea di separazione. Ogni zona ha proprietà caratteristiche specifiche.
I metalli sono malleabili, duttili, conducono elettricità e calore, e tendono a perdere elettroni formando ioni positivi. I non metalli hanno proprietà opposte e tendono ad acquistare elettroni.
La tavola può essere divisa in blocchi (s, p, d, f) in base al tipo di orbitale che si sta riempiendo. Gli elettroni di valenza (quelli esterni) determinano le proprietà chimiche di ogni elemento.
💡 Trucco utile: Il numero del gruppo indica quanti elettroni di valenza ha l'elemento - è la sua "firma chimica"!